
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Строение ферментов
|
|
Предшествующим событием при выполнении любой биологической функции белка является связывание его с другим соединением – субстратом. При связывании проявляется одно из важнейших свойств фермента – его специфичность. Для связывания необходимы контакт субстрата с активным центром фермента – контактной поверхностью белка, образованной несколькими специфическими R -группами аминокислот, расположенных определенным образом в пространстве.
Ферменты подразделяют на две группы:
1. Однокомпонентные, состоящие только из белковой молекулы;
2. Двухкомпонентные, в состав которых кроме белковой входит небелковая (непептидная) часть.
Коферменты – это органические вещества, обычно не аминокислотной природы. Они участвуют в переносе функциональных групп субстрата – атомов водорода, ацетила, аминогруппы и др. Фермент, содержащий кофермент, называют холоферментом, а белковую часть его – апоферментом или фероном. Отвечает за специфичность ферментов (каталаза и пероксидаза). Небелковая – агон или простетическая группа. Отвечает за активность фермента. Если простетическая группа отделяется от белка, она носит название кофермента. Реакция образования холофермента обратима:
Кофермент + Апофермент «Холофермент
Коферменты, как правило, входят в состав активного центра фермента.
Коферменты в своем составе содержат витамины и не могут синтезироваться организмом человека и животных. У ряда ферментов коферментами являются витамины В1, В2, В6, В12, РР, биотин, пантотеновая кислота и некоторые другие.
Рассмотрим в качестве примера фермент пируватдекарбоксилазу. Это типичный двухкомпонентный фермент, катализирующий расщепление пировиноградной кислоты на диоксид углерода и ацетальдегид:
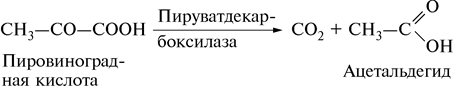
Химическая природа активной группы пируватдекарбоксилазы представляет собой соединение молекулы тиамина – витамина В1 и двух молекул фосфорной кислоты. Эта активная группа – тиаминпирофосфат, соединяясь со специфическим белком, образует фермент пируватдекарбоксилазу.
Витамин В2 (рибофлавин) входит в состав флавинмононуклеотида (FMN) и флавинадениндинуклеотида (FAD), которые являются коферментами аэробных дегидрогеназ. Витамин РР (амид никотиновой кислоты) – составная часть коферментов анаэробных дегидрогеназ: NAD+ (никотинамид-адениндинуклеотида) и NADР+ (никотинамидадениннукле-отидфосфата).
Коферменты термостабильны, а белковая часть фермента (апофермент) термолабильна и легко денатурирует при неблагоприятных внешних воздействиях.
В состав активного центра многих ферментов входят гидроксильные группы аминокислоты серина, карбоксильные группы аспарагиновой и глутаминовой кислот, аминные группы аминокислоты лизина, сульфгидрильные группы аминокислоты цистеина.