
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дикарбонильные соединения. 1,3-дикетоны, ацетоуксусный и малоновый эфиры.
|
|
Особое место среди широкого спектра ди- и поликарбонильных веществ занимают 1, 3-дикарбонильные соединения. Совместное влияние двух электроноакцепторных групп на расположенную между ними –СН2– группу приводит к резкому повышению кислотности С-Н связи.
С-Н кислотность некоторых дикарбонильных соединений
в сравнении с их моно-аналогами.
| Карбонильное соединение | рКа |
| ацетилацетон | 9, 0 |
| ацетоуксусный эфир | 10, 7 |
| диэтиловый эфир малоновой кислоты | 13, 0 |
| ацетальдегид | ~18 |
| ацетон | ~20 |
| этиловый эфир уксусной кислоты | ~25 |
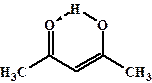 Для 1, 3-дикарбонильных соединений характерно заметное смещение кето-енольного равновесия в сторону енольной формы. Например, в этиловом эфире 3-оксобутановой кислоты (ацетоуксусном эфире) доля енольной формы около 8%, пентандион-2, 4 (ацетилацетон) в свободном состоянии енолизован на 80%, а циклогександион-1, 3 в свободном состоянии и в растворе присутствует практически только в форме енола. Это связано, во-первых, с высокой С-Н кислотностью соответствующих 1, 3-дикарбонильных соединений, и, во-вторых, с тем, что их енольная форма стабилизирована прочной внутримолекулярной водородной связью.
Для 1, 3-дикарбонильных соединений характерно заметное смещение кето-енольного равновесия в сторону енольной формы. Например, в этиловом эфире 3-оксобутановой кислоты (ацетоуксусном эфире) доля енольной формы около 8%, пентандион-2, 4 (ацетилацетон) в свободном состоянии енолизован на 80%, а циклогександион-1, 3 в свободном состоянии и в растворе присутствует практически только в форме енола. Это связано, во-первых, с высокой С-Н кислотностью соответствующих 1, 3-дикарбонильных соединений, и, во-вторых, с тем, что их енольная форма стабилизирована прочной внутримолекулярной водородной связью.
Так как по кислотности 1, 3-дикарбонильные соединения превосходят воду (рКа = 15, 7), то образование соответствующих енолятов возможно даже под действием таких оснований как поташ (К2СО3). Еноляты дикетонов и кетоэфиров дополнительно стабилизированы за счет делокализации отрицательного заряда на обеих карбонильных группах.

Образовавшийся анион проявляет нуклеофильные свойства по отношению к галоидным алкилам, карбонильным соединениям. В результате протекает алкилирование или ацилирование енолята. В связи с тем, что енолят анион проявляет амбидентный характер, то в зависимости от противоиона образуются продукты С- или О- алкилирования и ацилирования. Магниевые и отчасти натриевые и калиевые еноляты предпочтительно атакуются по атому углерода. Литиевые еноляты, наоборот склонны к взаимодействиям по кислородному атому. Дополнительные возможности в данной синтетической области открывает тот факт, что возможно двукратное селективное алкилирование или ацилирование разными реагентами. На схеме ниже представлены некоторые основные направления алкилирования 1, 3-дикарбонильных соединений на примере ацетоуксусного эфира.

 Ацилирование в большей степени направлено по кислородному центру с образованием сложных эфиров енолов.
Ацилирование в большей степени направлено по кислородному центру с образованием сложных эфиров енолов.
Частным случаем «алкилирования» (при n=0) является реакция енолятов натрия или магния с молекулярным бромом. Это взаимодействие приводит к сдваиванию дикарбонильного соединения.
Еще больше расширяет спектр получаемых продуктов способность 1, 3-дикарбонильных соединений к кислотному и кетонному расщеплению. Первая реакция основана на ретро -сложноэфирной конденсации (расщеплении ацетоуксусного эфира под действием сильных оснований). При этом остается сложный эфир карбоновой кислоты. С помощью кислотного расщепления производных ацетоуксусного эфира синтезируют сложные эфиры различных моно и дикарбоновых кислот.

Свободные карбоновые и дикарбоновые кислоты можно получить гидролизом продуктов алкилрования малонового эфира с последующим декарбоксилированием.

Кетонное расщепление ацетоуксусного эфира также заключается в гидролизе и последующем декарбоксилиовании соответствующего производного ацетоуксусной кислоты. С помощью кетонного расщепления получают разнообразные кетоны и дикетоны.
