
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Количественное определение
|
|
1. Броматометрия. Метод основан на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде:
KBrO3 + 5 KBr + 6 HCl → 3 Br2 + 6 KCl + 3 H2O
 Э=М/6
Э=М/6
Используют способы прямого (тимол) и обратного титрования (фенол, резорцин). При прямом способе титруют калия броматом в присутствии бромида с индикатором метилоранжем или метиловым красным до обесцвечивания. При обратном – добавляют избыток калия бромата, калия бромид, кислоту и выдерживают нужное для бромирования время, а затем избыток брома определяют йодометрически:
Br2 + 2 KI → I2 + 2 KBr
I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6
Индикатор – крахмал. Эквивалент зависит от количества присоединенного брома.
2. Йодометрия. Основана на электрофильном замещении атомов водорода ароматического кольца на йод:
 Э=М/6
Э=М/6
Для связывания йодоводородной кислоты, смещающей равновесие в обратную сторону, добавляют ацетат или гидрокарбонат натрия:
HI + NaHCO3 → NaI + CO2↑ + H2O
HI + CH3COONa → NaI + CH3COOH
Используют способы прямого и обратного титрования. В последнем - избыток йода оттитровывают тиосульфатом натрия. Параллельно ставится контрольный опыт.
3. Йодхлорметрия. Метод основан на электрофильном замещении атомов водорода в о - и п -положениях ароматического кольца на йод, входящий в состав йодмонохлорида. Используют способ обратного титрования - избыток йодмонохлорида определяют йодометрически.
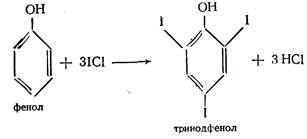
ICl + KI → I2 + KCl
I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6 Э=М/6
4. Метод ацетилирования. Используют для количественной оценки синэстрола.
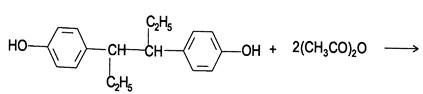
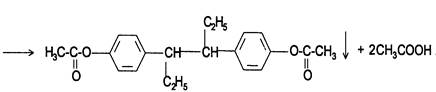
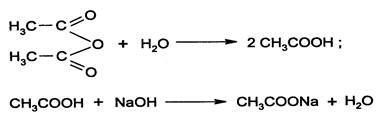 Э=М/2
Э=М/2
5. Алкалиметрия. Метод нейтрализации в среде протофильного растворителя диметилформамида (ДМФА). Фенолы проявляют очень слабые кислотные свойства, их определение алкалиметрическим методом нейтрализации в водных или смешанных средах невозможно, поэтому используют титрование в среде неводных растворителей, в частности, ДМФА. Метод основан на солеобразовании определяемой слабой кислоты (фенола) с титрантом – метилатом натрия в среде протофильного растворителя, усиливающего кислотные свойства:
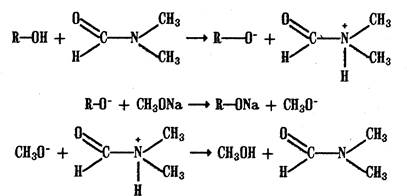
В качестве индикатора применяют тимоловый синий. Э=М
6. Фотоколориметрия (ФЭК) и спектрофотометория (СПФ). Методы основаны на свойстве окрашенных растворов поглощать немонохроматический (ФЭК) или монохроматический (СПФ) свет в видимой области спектра. В случае фенолов получают окрашенные соединения на основе реакций комплексообразования, азосочетания и образования индофенолового красителя.