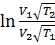Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение энергии активации
|
|
Причиной потери стабильности препарата является (его разложение) является химические реакции, происходящие при столкновении молекул. Скорость распада вещества пропорциональна частоте столкновений. Но т.к. не каждое столкновение приводит к химической реакции, значит существует минимальная энергия, которой должна обладать молекула, для преодоления этого барьера. Эта энергия называется энергией активации ЕА.. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией выше энергии активации, пропорционально  .
.
В результате скорость химической реакции представляется уравнением Аррениуса: k = A· 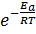 ,
,
где k – константа скорости химической реакции, А - характеризует частоту столкновений реагирующих молекул, R – универсальная газовая постоянная (R = К·NA, NA – число Авогадро NA = 6, 02·1023 [моль− 1]).
Уравнение Аррениуса отражает вероятность, что при столкновении происходит химическое взаимодействие молекул.
Рассмотрим столкновение двух молекул с протеканием химической реакции А + А В. Рассмотрим реакцию при двух различных температурах Т1 и Т2. Т.к. не учитываем количество вещества, то далее заменим R на К.
V1 = L·n2·  ·
·  (1)
(1)
V2 = L·n2·  ·
·  (2)
(2)
Разделив уравнение (1) на (2). Получим:  =
= 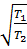 ·
· 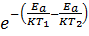
Преобразуем это выражение, затем прологарифмируем. Получим:
EA = 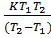 ·
·