
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
И его применение к различным процессам
|
|
Первый закон термодинамики является количественной формулировкой всеобщего закона сохранения энергии применительно к процессам, связанным с превращениями теплоты и работы. Он утверждает, что в любой изолированной системе запас энергии остается постоянным.
Первый закон термодинамики возник в эпоху создания тепловых двигателей. С появлением тепловых машин перед человечеством встала естественная задача создания экономически выгодных машин. Предпринимались многочисленные попытки создания вечного двигателя I рода − тепловой машины, производящей работу без затрат энергии.
Невозможно создать вечный двигатель I рода − это утверждение также является одной из формулировок первого закона термодинамики.
Необходимо отметить, что первый закон термодинамики представляет собой постулат − он не может быть доказан логическим путем или выведен из каких-либо более общих положений. Истинность этого закона подтверждена многолетним опытом человечества.
Первый закон термодинамики устанавливает связь между теплотой Q, работой А и изменением внутренней энергии системы D U.
 Пусть к закрытой системе подведено некоторое количество теплоты Q. Согласно первому закону термодинамики эта теплота идет в общем случае на увеличение внутренней энергии и на совершение системой работы:
Пусть к закрытой системе подведено некоторое количество теплоты Q. Согласно первому закону термодинамики эта теплота идет в общем случае на увеличение внутренней энергии и на совершение системой работы:
Q = D U + A. (1.2)
Для бесконечно малых величин
 . (1.3)
. (1.3)
Знак d в уравнении (1.3) отражает тот факт, что теплота и работа − функции процесса и их бесконечно малое изменение не является полным дифференциалом.
В уравнениях (1.2) и (1.3) используется термодинамическая система знаков: теплота положительна, если она передается системе; работа положительна, если она совершается системой.
В общем случае работа является суммой нескольких качественно различных видов работ (механической, электрической, магнитной, поверхностной и др.). Принято все виды работ за исключением работы расширения (сжатия) называть полезной работой  . С учетом этого первый закон термодинамики примет вид:
. С учетом этого первый закон термодинамики примет вид:
 .
.
Если совершается только работа расширения (сжатия) pdV, то
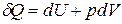 . (1.4)
. (1.4)
Рассмотрим простейшую термодинамическую систему – газ, находящийся в цилиндре с поршнем. При подводе к нему теплоты Q газ нагревается (следовательно, увеличивается его внутренняя энергия) и расширяется (совершается работа). Таким образом, теплота расходуется частично на увеличение внутренней энергии и частично на совершение работы против внешних сил.
Применим уравнение (1.4) для анализа основных термодинамических процессов.
1) Изохорный процесс (V = const, dV = 0). Так как работа расширения при этом равна 0, то, очевидно, что вся теплота, подведенная к системе, идет на увеличение внутренней энергии:
 ,
,
 .
.
Таким образом, теплота изохорного процесса равна изменению внутренней энергии и, следовательно, является функцией состояния.
2) Изобарный процесс (p = const, dp = 0).
Уравнение (1.4) в этом случае запишется в виде
 ,
,
где U + pV = H − функция состояния системы, называемая энтальпией.
 ,
,
Qp = D H.
Таким образом, теплота изобарного процесса равна изменению энтальпии и является функцией состояния.
Получим формулу для расчета работы расширения, совершаемой в изобарном процессе.
d А = pdV.
Проинтегрируем в интервале от V 1 до V 2:
 .
.
Для изобарного процесса, протекающего в идеальном газе, в соответствии с уравнением Менделеева-Клапейрона (1.1) для начального и конечного состояния
 ,
,
работа расширения равна
 .
.
Если протекает изобарно-изотермический процесс (р, Т = const), уравнение принимает вид:
 ,
,
где 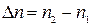 .
.
Связь между QV и Qp определяется уравнением:
 .
.
Для реакций, протекающих с участием только конденсированных фаз, объем системы практически не изменяется (D V = 0) и Q p» Q v. Для реакций, протекающих с участием веществ в газообразном состоянии, в том числе идеальных и реальных газов при невысоких давлениях, к которым применимо уравнение Менделеева-Клапейрона, изменение объема вызвано уменьшением или увеличением числа моль газообразных компонентов в системе
 ,
,
где D n – изменение числа моль газообразных продуктов реакции и исходных веществ:
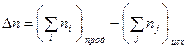 .
.
Следовательно,
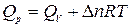
или  .
.
3. Изотермический процесс (Т = const)
Рассмотрим изотермический процесс, протекающий в идеальном газе. Согласно закону Гей-Люссака-Джоуля внутренняя энергия идеального газа зависит только от температуры и не зависит от давления и объема. Это значит, что при
Т = const Δ U = 0. Следовательно, для идеального газа в изотермическом процессе работа совершается только за счет поглощаемой теплоты
 .
.
Для идеального газа в соответствии с уравнением (1.1)
 ,
,
 .
.
После интегрирования
 .
.
При Т = const
 ,
,
тогда
 .
.
4) Адиабатический процесс осуществляется без теплообмена с окружающей средой (d Q = 0).
d A = − dU,
A = − D U.
В адиабатическом процессе работа может совершаться только за счет убыли внутренней энергии.