
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема № 7
|
|
Инженерная энзимология. Ферменты медицинского назначения. Методы выделения и оценки ферментов микробного происхождения. Иммобилизованные клетки и ферменты в биотехнологическом производстве. Методы иммобилизации ферментов и целых клеток. Сферы практического применения иммобилизованных ферментов и целых клеток
Задание № 252
1. Методы иммобилизации ферментов. Химическая иммобилизация ферментов: иммобилизация ферментов за счет образования ковалентных связей между ферментом и
носителем. Преимущества и недостатки метода. Сферы практического применения таких иммобилизованных ферментов. Примеры.
Книга 7 стр 86.
Существует два основных метода иммобилизации ферментов: физический и химический.
Физическая иммобилизация ферментов представляет собой включение фермента в такую среду, в которой для него доступной является лишь ограниченная часть общего объема. При физической иммобилизации фермент не связан с носителем ковалентными связями. Существует четыре типа связывания ферментов:
- адсорбция на нерастворимых носителях;
- включение в поры геля;
- пространственное отделение фермента от остального объема реакционной системы с помощью полупроницаемой перегородки (мембраны);
- включение в двухфазную среду, где фермент растворим и может находиться только в одной из фаз
Химические методы иммобилизации ферментов. Иммобилизация ферментов путем образования новых ковалентных связей между ферментом и носителем - наиболее массовый способ получения промышленных биокатализаторов.
В отличие от физических методов этот способ иммобилизации обеспечивает прочную и необратимую связь фермента с носителем и часто сопровождается стабилизацией молекулы энзима. Однако расположение фермента относительно носителя на расстоянии одной ковалентной связи создает стерические трудности в осуществлении каталитического процесса. Фермент отделяют от носителя с помощью вставки (сшивка, спейсер), в роли которой чаще всего выступают бифункциональные и полифункциональные агенты (бромциан, гидразин, сульфурилхлорид, глутаровый диальдегид и др.).
Иммобилизация ферментов на носителях, обладающих гидроксо-группами. Наиболее распространенным методом образования ковалентной связи между ферментом и полисахаридным носителем или синтетическим диольным
соединением является бромциановый метод, который был предложен Р.Аксеном,
Дж. Поратом и С.Эрнбаком в 1967 г. При обработке носителя бромцианом возникают реакционноспособные цианаты и имидокарбонаты, которые при взаимодействии с нуклеофильными аминогруппами фермента образуют производные изомочевины и уретанов:
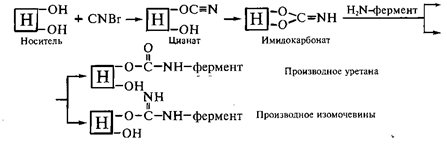
^ Иммобилизация ферментов носителях, обладающих аминогруппами. Первичные аминогруппы носителя, связанные с ароматическим кольцом, предварительно превращают в соли диазония, которые затем подвергают разнообразным реакциям сочетания. В реакции сочетания вступают фенольные, имидазольные, аминные, гуанидиновые, тиольные группы белков. Так, в щелочной среде фенольные радикалы тирозина образуют прочные азо-соединения, в составе которых белок связан с носителями:

Существенно, что п-аминофенильные функции могут быть легко введены в разнообразные носители.
Иммобилизация на носителях, обладающих активированными производными карбоксильной группы. Наиболее часто для соединения аминогрупп белка с ацильными группировками носителя используют ангидриды, галогенангидриды, активированные эфиры и другие производные карбоновых кислот. Например,
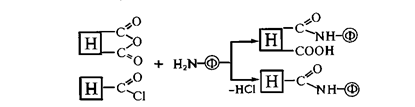
Реакционная способность производных карбоновых кислот в реакциях ацилирования аминогрупп фермента уменьшается от галогенангидридов до эфиров.
Иммобилизация на носителях, обладающих сульфгидрилъными группа-ми. Сульфгидрильные группы носителя и фермента легко окисляются с образова-нием дисульфидных связей под действием кислорода воздуха:
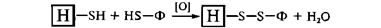
Иммобилизация путем химического присоединения биокатализатора к носителю отличается высокой эффективностью и прочностью связи. Несмотря на это, методы ковалентной иммобилизации ферментов все еще малодоступны для промышленного использования в связи со сложностью и дороговизной их применения. Однако они остаются незаменимыми инструментами в практике проведения научных и лабораторных исследований по созданию энзимов с контролируемыми свойствами.
2. Тестовое задание:
Область использования грибных пептидаз?
а) в производстве сыров;
б) в производстве моющих средств;
в) в производстве напитков – для предотвращения мути;
г) для стандартизации процесса хлебопечения.