
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способы выражения концентрации раствора
|
|
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие:
Массовая доля растворенного вещества W (B) – отношение массы растворенного вещества к общей массе раствора, выражается в долях единицы или в процентах:

где m(B) и m(A) – масса растворенного вещества B и масса растворителя A.
Раствор вещества с массовой долей 0, 2 (20%) означает, что в 100 г раствора содержится 20 г вещества и 80 г растворителя. Такие растворы готовят взвешиванием растворенного вещества и растворителя.
Объемная доля растворенного вещества σ (B) – отношение объема растворенного вещества к общему объему раствора, выражается в долях единицы или объемных процентах, используется в случае газообразных систем:

где Vi – объем компонента раствора, V(B) – объем растворенного вещества B. Объемные проценты называют градусами.
Мольная доля растворенного вещества χ (B) – отношение количества молей растворенного вещества n к общему количеству молей в растворе, выражается в относительных единицах или процентах:


Сумма мольных долей k компонентов раствора χ i равна единице 
К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества Cm(B) определяется количеством растворенного вещества n(B) в 1 кг (1000 г) растворителя A, размерность моль/кг:
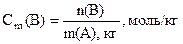 или
или 
Раствор с концентрацией 0, 5 моль/кг называют 0, 5 моляльным.
Молярная концентрация вещества B в растворе Cм(B) – содержание количества растворенного n вещества B в единице объема раствора, размерность моль/дм3, или чаще моль/литр:
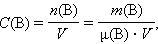
где μ (B) – молярная масса вещества B, V – объем раствора.
Раствор, в котором молярная концентрация растворенного вещества равна C (B) (моль/л), характеризуется молярноcтью, численно равной молярности раствора – М (после числа). Например, раствор с молярной концентрацией сульфата калия 1 моль/л может быть обозначен как 1М K2SO4 (одномолярный раствор сульфата калия в воде). Аналогичным образом записи 0, 1М, 0, 01М и 0, 001М означают соответственно деци-, санти- и миллимолярный растворы.
Моляльность, мольная доля и массовая доля широко применяются в физико-химических исследованиях, так как они не связаны с объемом раствора и не зависят от температуры. В аналитической химии для количественных определений часто пользуются титрованными растворами (растворами с известным титром), а также растворами с известной эквивалентной (нормальной) концентрацией.
Эквивалентная (нормальная) концентрация Сэ (молярная концентрация эквивалентов вещества B определяется числом эквивалентов растворенного вещества nэ в единице объема раствора, размерность моль-экв/литр:

где nЭ(B) – количество эквивалентов вещества, μ Э – молярная масса эквивалента (эквивалентная масса).
Молярная масса эквивалента (эквивалентная масса) соотносится с молярной массой следующим образом:
для кислот: 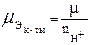 ;
;
для оснований:  ;
;
для солей и оксидов: 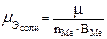 ,
,
где nH+ – основность кислоты; nOH- – кислотность основания; nMe – число атомов металла в молекуле соли или оксида; BMe – валентность металла.
Например:
μ 
| μ 
|
μ 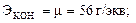
| μ 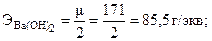
|
μ 
| μ 
|
Отсюда следует, что для кислот CЭ = CM. nH+; для оснований CЭ = CM. nOH-; для солей и оксидов CЭ = CM. nMe. BMe.
Раствор, в котором эквивалентная концентрация растворенного вещества равна Сэ характеризуется нормальноcтью, обозначение нормальности раствора – н. (поcле числа). Например, раствор с эквивалентной концентрацией серной кислоты 1 моль-экв/л может быть обозначен как
1 н. H2SO4 (однонормальный раствор серной кислоты в воде).
Титр раствора вещества B определяется массой растворенного вещества, содержащегося в 1 мл раствора; T B, г/мл:
 , г/мл
, г/мл
Моляльность, мольная доля и массовая доля широко применяются в физико-химических исследованиях, так как они не связаны с объемом раствора и не зависят от температуры; объемные концентрации относятся к определенной температуре.