
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Применение в химии
|
|
В химических процессах одновременно действуют два противоположных фактора — энтропийный (T Δ S) и энтальпийный (Δ H). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (G):
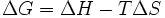 .
.
Δ G=Δ H-TΔ s - свободная энергия Гиббса (p=const)
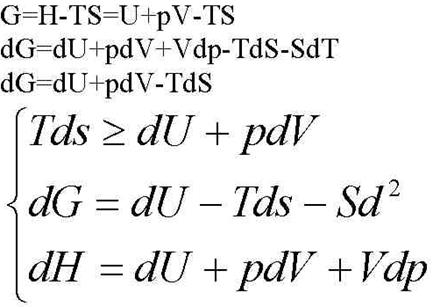
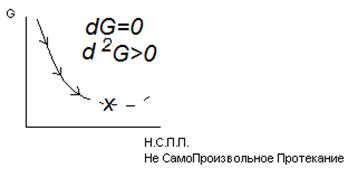
Совместно решая 1-3 и исключая dH, учитывая: dT=0, dV=0, получаем dG≤ 0
В системах при P=const и T=const самопроизвольно протекают процессы, сопровождающиеся уменьшением энергии Гиббса.
Предел протекания этих процессов – минимальное значение G Т.е. если Δ G> 0 – прямая реакция невозможна
Δ G< 0 – прямая реакция возможна
Δ G=0 – реакция обратима
из лекции:
Свободная энергия Гиббса.: G=H-TS(Дж\моль)
Процесс при P, V=const
TdS> =dU+pdV (*)
dG=dH-TdS-SdT(**)
dH=dU+pdV+Vdp (***)
**dG=dH-TdS-SdT, H=U+PV, то dH=dU+pdV+Vdp**
Решая систему уравнений из (*)(**)(***), учитывая, что dP=0.dT=0, получаем, что dG=0
В системе, при P, V=const самопроизвольно протекают процессы с уменьшением энергии Гиббса.
Предел протекания таких процессов – минимальное значение энергии Гиббса(G).