
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
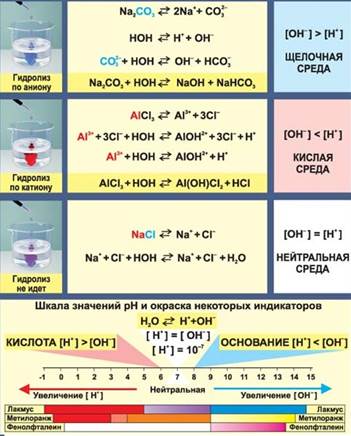
Соль образована слабым основанием и слабой кислотой
|
|
Соль образована сильным основанием и сильной кислотой
КСl + H2O ↔ не гидролизуется
КСl ↔ К+ + Сl-
Н2О ↔ OH- + H+
Гидролизу подвергаться не будет, потому что катионы и анионы соли не связываются с ионами OH-или H+ воды. В этом случае не образуется слабый электролит.
Среда растворов этих солей – нейтральная (рН=7), так как концентрации ионов OH- и H+ в их растворах равны, как в чистой дистиллированной воде. Индикаторы окраску не изменяют.
Соль образована сильным основанием и слабой кислотой
Гидролиз средних солей многоосновных кислот приводит к образованию кислых солей:
Соль образована слабым основанием и сильной кислотой
Гидролиз средних солей многокислотных оснований приводит к образованию основных солей:
Соль образована слабым основанием и слабой кислотой
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
Соли, образованные слабым нерастворимым или летучим основанием и слабой нерастворимой или летучей кислотой гидролизуются полностью и необратимо с образованием соответствующего основания и соответствующей кислоты.
Как гидролиз можно усилить:
•Добавить воды.
•Нагреть раствор (увеличится диссоциация воды).
•Связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу.
Как гидролиз можно подавить:
•Увеличить концентрацию растворённого вещества.
•Охладить раствор.
•Ввести в раствор один из продуктов гидролиза: подкислять (если рН < 7) или подщелачивать (если рН> 7).
|