
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоритическая часть.
|
|
Определение рН кислотных осадков.
Для охраны окружающей среды имеет большое значение решение проблемы кислотных осадков.
Кислотными называются любые осадки - дожди, туманы, снег, -кислотность которых выше нормальной. К ним также относят выпадение из атмосферы сухих кислых частиц, более узко называемых кислотными отложениями.
Загрязнение атмосферы соединениями серы. Соединения серы попадают в атмосферу, как естественным путем, так и в результате антропогенной деятельности (табл.1). При отсутствии источников загрязнения диоксид серы (SO2) встречается в атмосфере в виде ничтожных следов. Единственным крупным естественным источником диоксида серы является вулканическая деятельность. В основном SO2 поступает в атмосферу в результате человеческой деятельности. Главная причина загрязнения им атмосферы - сжигание ископаемого топлива, которое содержит серу. В процессе горения часть серы окисляется до SO2. Среди используемых видов топлива первое место по поставке диоксида серы занимает каменный уголь, второе - нефть, а природный газ находится на третьем месте. Наиболее распространенными соединениями серы, поступающими в атмосферу, являются диоксид серы (SO2), сульфиты (S04), сероуглерод (CS2) и сероводород (Н2S).
Таблица 1 Природные и антропогенные источники загрязнений атмосферы соединениями серы.
| Источники | Количество выбросов в год | |
| млн т. | % | |
| Природные Процессы разрушения биосферы Вулканическая деятельность Поверхность океанов | 30-40 30 - 200 60-70 | 29-39 – 59-69 |
| Антропогенные | 60–70 | 59–69 |
Основными источниками образования SO2 является также металлургическая промышленность (переработка сульфидных руд меди, свинца и цинка), а также предприятия по производству серной кислоты и переработке нефти.
Основной вред окружающей среде наносит не столько сам диоксид серы, сколько продукт его окисления - S03. Процесс окисления осуществляется под действием кислорода на пылеобразных частицах оксидов металлов в качестве катализаторов, в атмосферной влаге или под действием солнечного света.
Загрязнение атмосферы соединениями азота. Оксиды азота образуются в атмосфере как естественным, так и антропогенным путем при горении ископаемого топлива. Загрязнение атмосферы оксидами азота в целом сравнительно невелико. Однако в районах с развитой химической промышленностью имеются локальные зоны повышенного содержания N0, N02 в воздухе (табл.3)
Таблица 3. Соединения азота и их концентрации в приземном слое атмосферы.
| Соединение | Концентрация азота, мкг/м3 | ||
| загрязненный район | отдаленный район | океан | |
| NO | 5 - 50 | 0.05 - 0.5 | 0.05 |
| NO2 | 5-50 | 0, 2 - 2, 0 | 0, 2 |
| HNO3 | 0.2- 2 | 0.2 | |
| NH3 | - | 0.1 - 10 | 0.3 |
| NO3 | 0.1 - 0.4 | 0.02 | |
| NH4 | - | 1, 0 - 2, 0 | 0.4 |
Основными антропогенными источниками поступления оксидов азота в атмосферу является сжигание всех видов природного топлива (12 млн.т./год), транспорт (8 млн.т./год) и промышленность (1 млн.т./год).
Влияние кислотных осадков на экосистемы. Уже более ста лет кислотные осадки признаются серьезной проблемой в индустриальных и прилегающих к ним районах, но их влияние на экосистемы было отмечено только около 35 лет назад, когда рыбаки заметили резкое сокращение популяций рыбы во многих озерах Швейцарии, провинции Онтарио (Канада) и гор Адирондак (штат Нью-Йорк). Шведские ученые первыми определили, что все дело в повышенной кислотности воды, и связали ее с ненормально низкими значениями рН осадков. С тех пор выяснились различные пути разрушительного влияния кислотных осадков на экосистемы:
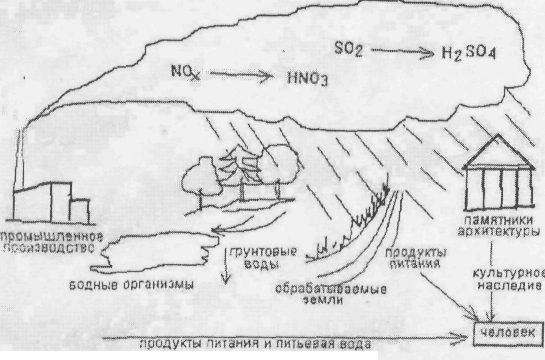
Схема возможных направлений влияния кислотных осадков на окружающую среду и человека.
Влияние на водные экосистемы. Наиболее очевидное влияние кислотные осадки оказывают на водные экосистемы. В пресноводных водоемах рН воды обычно равен 6 - 7. Снижение рН до 5 приводит к постепенному вымиранию рыб. Однако нельзя считать, что взрослая рыба просто погибает в большом числе из-за повышенной кислотности воды в этих озерах. На самом деле сильно закисленные воды не позволяют рыбе нормально размножаться. Самки могут оказаться не способными выметать икру в кислой воде, если же икра все-таки попадает в воду, то она либо погибает, либо из нее вылупляются нежизнеспособные мальки.
Из-за воздействия кислотных дождей может сокращаться численность лягушек, жаб и тритонов. Многие из этих видов размножаются во временных водоемах, возникающих в период весенних дождей; вода в них может быть даже более кислой, чем в озерах, поскольку эти временные водоемы образованы только дождевой водой с повышенной кислотностью.
Влияние на леса. Кислотные дожди отрицательно воздействуют не только на животных, но и на растения. Опыты с моделированием кислотных дождей в теплицах продемонстрировали, что кислоты нарушают защитный восковой покров листьев, делая растения более уязвимыми для насекомых, грибов и других патогенных организмов.
Кроме того, при поглощении почвами кислотный дождь выщелачивает соли калия, кальция, магния и, унося их в подпочвенный слой, лишает растения необходимых им питательных веществ.
Почвы, так же как и водоемы, по-разному реагируют на выпадение кислотных осадков. Чем больше в почве содержится карбоната кальция, тем меньше она подвержена закислению.
Влияние на людей и изделия. Одно из наиболее ощутимых последствий кислотных осадков - разрушение произведений искусства. Известняк и мрамор - излюбленные материалы для оформления фасадов зданий и сооружения памятников. Под действием кислотных дождей ускоренно корродируют металлоконструкции, нарушается целостность лакокрасочных покрытий, разрушаются здания и памятники архитектуры. Памятники и здания, простоявшие сотни и тысячи лет лишь с незначительными изменениями, сейчас растворяются и рассыпаются в крошево. Кислотные осадки разрушают строительные материалы, образованные карбонатом кальция (мрамор, известняк и др.). При взаимодействии с серной кислотой карбонат кальция превращается в гипс (СaSO4. 2Н2О), который легко крошится, нарушая целостность конструкции.
Для предупреждения опасного воздействия кислотных осадков на экосистемы и антропогенные сооружения необходимо добиваться снижения выбросов в атмосферу оксидов серы и азота.
Ход работы
Оборудование и реактивы.
Бюретка на 25 мл.
Мерный цилиндр на 25 мл.
Колбы конические на 250 мл – 3 шт.
Мерный стакан и воронка.
Раствор КОН.
Индикатор фенолфталеин.
Ход выполнения.
В коническую колбу мерным цилиндром отбирают 25 мл кислотных осадков определенного образца. В бюретку, закрепленную в штативе, наливают титрант КОН и доводят его объем до нулевой отметки, предварительно заполнив носик бюретки. В каждую колбу добавляют 3–4 капли индикатора фенолфталеина и титруют раствором КОН до перехода окраски от бесцветной к слабо–розовой, неисчезающей в течение 20 сек. Результаты титрования записывают в журнал, находят среднее арифметическое из трех определений и полученный результат подставляют в формулу, рассчитывая значение концентрации [Н+]:, где
С[ОН–] – концентрация КОН, (г экв/л);
V[ОН–] – объем раствора КОН, пошедший на титрование, мл;
V [Н+] – объем кислотных осадков взятый для определения, мл.
Вычисляют значение рН по формуле:
рН = – lg С[Н+].
Вывод.
Полученные результаты рН сравнивают со шкалой и делают вывод о рН исследуемого образца.
Практическая часть:
Мы брали образец №1.
1 значение: 9
2 значение: 9, 4 Среднее арифметическое: 9, 2
3 значение: 9, 3
Сн=0, 004*9, 2/25=0, 0368/25=0, 0014
Вычислим значение рН:
рН=-lg[0, 0014]=2, 9
Вывод: данный кислотный осадок является кислотным, т.к. рН < 5, 5.
|