
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Построение калибровочных графиков
|
|
Калибровочный график – это зависимость оптической плотности от концентрации раствора.
Для построения необходимо приготовить серию растворов красителя в 10 чистых пузырьках.
1. 1 мл красителя и 9 мл кислоты;
2. 2 мл красителя и 8 мл кислоты;
3. 3 мл красителя и 7 мл кислоты;
4. 4 мл красителя и 6 мл кислоты;
5. 5 мл красителя и 5 мл кислоты;
6. 6 мл красителя и 4 мл кислоты;
7. 7 мл красителя и 3 мл кислоты;
8. 8 мл красителя и 2 мл кислоты;
9. 9 мл красителя и 1 мл кислоты;
10. исходный раствор.
Концентрации приготовленных растворов вычислили по правилу эквивалентов: С1·V1 = C2·V2
Таблица 3. Определение концентрации красителя в кислом растворе
| Серии растворов краситель: раствор | Концентрация красителя в кислой среде, моль/л |
| 10 мл красителя | 1·10-4 |
| 1 мл: 9 мл | 1·10-4·1 = Х1·10 Х1 = 0, 1·10-4 |
| 2 мл: 8 мл | 1·10-4·2 = Х2·10 Х2 = 0, 2·10-4 |
| 3 мл: 7 мл | 1·10-4·3 = Х3·10 Х3 = 0, 3·10-4 |
| 4 мл: 6 мл | 1·10-4·4 = Х4·10 Х4 = 0, 4·10-4 |
| 5 мл: 5 мл | 1·10-4·5 = Х5·10 Х5 = 0, 5·10-4 |
| 6 мл: 4 мл | 1·10-4·6 = Х6·10 Х6 = 0, 6·10-4 |
| 7 мл: 3 мл | 1·10-4·7 = Х7·10 Х7 = 0, 7·10-4 |
| 8 мл: 2 мл | 1·10-4·8 = Х8·10 Х8 = 0, 8·10-4 |
| 9 мл: 1 мл | 1·10-4·9 = Х9·10 Х9 = 0, 9·10-4 |
Для построения калибровочного графика, измерили оптическую плотность приготовленных растворов при рабочей длине волны λ = 315 нм. В качестве раствора сравнения использовали 0, 1н раствор HCl.
Таблица 4. Зависимость оптической плотности от концентрации в кислой среде
| Концентрация С∙ 10-4, моль/л | 0, 1 | 0, 2 | 0, 3 | 0, 4 | 0.5 | 0.6 | 0.7 | 0, 8 | 0, 9 |
| Оптическая плотность, D | 0, 11 | 0, 23 | 0, 38 | 0, 49 | 0, 59 | 0, 72 | 0, 81 | 0, 93 | 1, 1 |
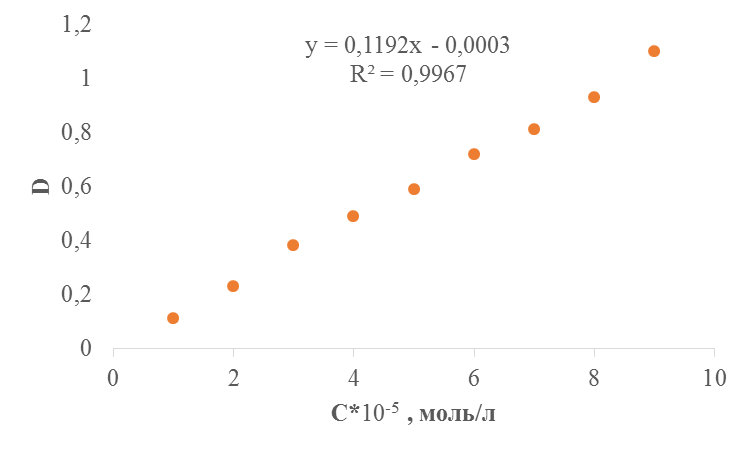
Рис 2. Калибровочный график определения концентрации красителя Кислотного желтого Светопрочного в 0, 1н растворе HCl. l = 1см, λ = 315 нм.
По такому же методу готовили серии из 10 растворов красителя в растворе щелочи. Вычислили концентрации приготовленных растворов:
Таблица 5. Определение концентрации красителя в щелочном растворе
| Серии растворов краситель: раствор | Концентрация красителя в щелочной среде, моль/л |
| 10 мл красителя | 1·10-4 |
| 1 мл: 9 мл | 1·10-4·1 = Х1·10 Х1 = 0, 1·10-4 |
| 2 мл: 8 мл | 1·10-4·2 = Х2·10 Х2 = 0, 2·10-4 |
| 3 мл: 7 мл | 1·10-4·3 = Х3·10 Х3 = 0, 3·10-4 |
| 4 мл: 6 мл | 1·10-4·4 = Х4·10 Х4 = 0, 4·10-4 |
| 5 мл: 5 мл | 1·10-4·5 = Х5·10 Х5 = 0, 5·10-4 |
| 6 мл: 4 мл | 1·10-4·6 = Х6·10 Х6 = 0, 6·10-4 |
| 7 мл: 3 мл | 1·10-4·7 = Х7·10 Х7 = 0, 7·10-4 |
| 8 мл: 2 мл | 1·10-4·8 = Х8·10 Х8 = 0, 8·10-4 |
| 9 мл: 1 мл | 1·10-4·9 = Х9·10 Х9 = 0, 9·10-4 |
Для построения калибровочного графика необходимо измерили оптическую плотность приготовленных растворов при рабочей длине волны λ = 440 нм. В качестве раствора сравнения использовали 0, 1н раствор NaOH.
Таблица 6. Зависимость оптической плотности от концентрации в щелочной среде
| Концентрация С∙ 10-4, моль/л | 0, 1 | 0, 2 | 0, 3 | 0, 4 | 0.5 | 0.6 | 0.7 | 0, 8 | 0, 9 |
| Оптическая плотность, D | 0, 085 | 0, 18 | 0, 25 | 0, 39 | 0, 42 | 0, 53 | 0, 61 | 0, 72 | 0, 85 |
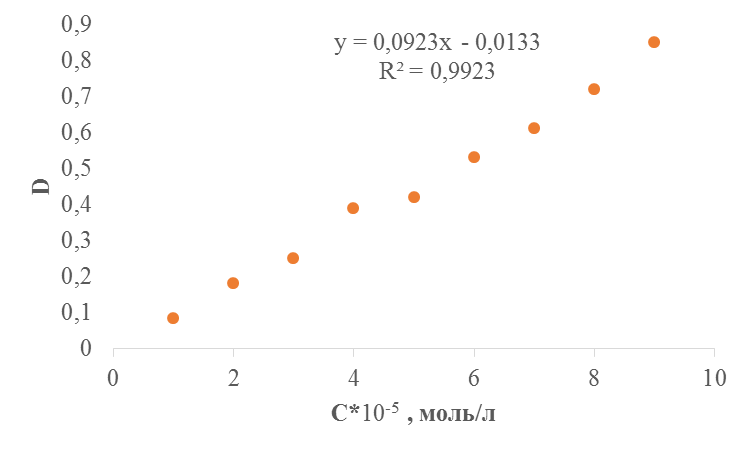
Рис.3. Калибровочный график определения концентрации красителя Кислотного желтого Светопрочного в 0, 1н растворе NaOH. l = 1 см, λ = 440 нм.