
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Недиссоциированные молекулы и ионы имеют различную окраску.
|
|
| Индикатор | Окраска индикатора | |
| в растворе молекулы | в растворе ионы | |
| фенолфталеин | бесцветный | малиновый |
| метиловый оранжевый | красный | желтый |
| метиловый красный | красный | желтый |
Так как индикаторы представляют собой слабые кислоты или основания, то они характеризуются константой диссоциации или рК индикатора.

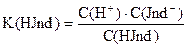
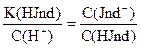

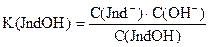
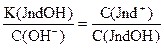
Таким образом, переход одной окраски, присущей молекулярной форме кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием Н+ или ОН- ионов., т.е. зависит от рН раствора.
Пример. Метиловый оранжевый индикатор – органическая кислота.
а) В кислом растворе
 HJnd H+ + Jnd-
HJnd H+ + Jnd-
 |
HCl = H+ + Cl-
Увеличивается концентрация ионов H+, равновесие смещается в сторону молекул.
Индикатор окрашивается в красный цвет (молекулярная форма).
б) В щелочном растворе
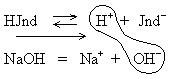
Происходит связывание ионов H+ и OH-, образуется слабый электролит Н2О, равновесие смещается в сторону ионов.
Индикатор окрашивается в желтый цвет (ионная форма).
При известном соотношении количеств молекулярной и ионной форм индикатора раствор может иметь промежуточную (переходную) окраску, вызываемую смешиванием двух различных цветов молекулярной и ионной форм индикатора.
Так, у метилового оранжевого индикатора смешение красного и желтого цветов приводит к появлению промежуточной оранжевой окраски, наблюдаемой при рН» 4.
 HJnd H+ + Jnd-
HJnd H+ + Jnd-
красная оранжевая желтая