
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Анализ технической щелочи (NaOH или КОН)
|
|
NaOH + HCl = NaCl + H2O
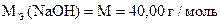
Способ титрования: прямой.
Способ взятия навески: пипетирование.
Индикатор: метиловый оранжевый, метиловый красный, фенолфталеин.
Аликвоту раствора (объем пипетки) титруют стандартным раствором HCl до появления оранжевой окраски (метиловый оранжевый, метиловый красный индикаторы) или до появления бледно-розовой окраски (фенолфталеин).
Пример расчета.
Навеска технического едкого натра 0, 9213 г растворена в мерной колбе 100 мл.
На титрование 10, 00 мл полученного раствора потребуется 10, 20 мл раствора HCl.
Вычислить процентное содержание NaOH в образце, если Т(HCl/KOH) = 0, 005610 г/мл.
Дано:
m н = 0, 9213 г
Т(HCl/KOH) = 0, 005610 г/мл
Vк = 100, 00 мл
Vn = 10, 00 мл
V (HCl) = 10, 20 мл
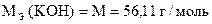
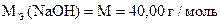
|
| w (NaOH) =? |
Решение:
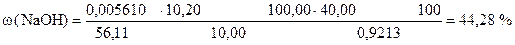
‚ ƒ „ … † ‡
| - | Сколько моль-экв КОН эквивалентно 1 мл раствора HCl. Столько же моль-экв HCl содержится в 1 мл раствора. |
| ‚ - | Сколько г HCl содержится в 10, 20 мл раствора. Столько же моль-экв NaOH содержится в 10, 00 мл раствора. |
| ƒ - | Сколько моль-экв NaOH содержится в 1 мл раствора. |
| „ - | Сколько моль-экв NaOH содержится в 100, 00 мл раствора. |
| … - | Сколько г NaOH содержится в 100, 00 мл раствора. Столько же г NaOH содержится в навеске. |
| † - | Сколько г NaOH содержится в 1 г образца. |
| ‡ - | Сколько г NaOH содержится в 100 г образца или w (NaOH). |
9.8. Анализ питьевой соды (NaHCO3)
NaHCO3 + HCl = NaCl + H2CO3
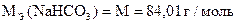
Способ титрования: прямой.
Способ взятия навески: пипетирование.
Индикатор: метиловый оранжевый.
Аликвоту раствора (объем пипетки) титруют стандартным раствором HCl до появления оранжевой окраски.
Пример расчета.
Навеска питьевой соды 0, 5014 г растворена в мерной колбе 50 мл.
На титрование 5, 00 мл полученного раствора расходуется 5, 10 мл раствора HCl.
Вычислить процентное содержание NaHCO3 в образце,
если Т(HCl/NaHCO3) = 0, 001025 г/мл.
| Дано: m н = 0, 5014 г Т(HCl/NaHCO3) = 0, 001025 г/мл Vк = 50, 00 мл Vn = 5, 00 мл V (HCl) = 5, 10 мл |
| w (NaHCO3) =? |
Решение:
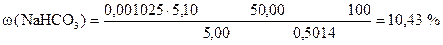
‚ ƒ „ …
| - | Сколько г NaHCO3 эквивалентно 5, 10 мл раствора HCl. Столько же г NaHCO3 содержится в 5, 00 мл раствора. |
| ‚ - | Сколько г NaHCO3 содержится в 1 мл раствора. |
| ƒ - | Сколько г NaHCO3 содержится в 50, 00 мл раствора. Столько же г NaHCO3 содержится в навеске. |
| „ - | Сколько г NaHCO3 содержится в 1 г образца. |
| … - | Сколько г NaHCO3 содержится в 100 г образца или w (NaHCO3). |
9.9. Анализ технической соды (Na2CO3)
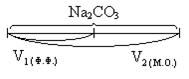
V1 = VHCl эквивалентный 1/2 Na2CO3
V2 = VHCl эквивалентный Na2CO3
| Ф.Ф. | Na2CO3 + HCl = NaHCO3 + NaCl
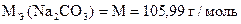
|
| М.О. | Na2CO3 + 2HCl = H2CO3 + 2NaCl
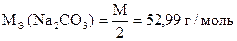
|
Способ титрования: прямой.
Способ взятия навески: пипетирование.
Индикатор: фенолфталеин и метиловый оранжевый.
Аликвоту раствора (объем пипетки) титруют стандартным раствором HCl с индикатором фенолфталеином до бледно-розовой окраски, а затем с метиловым оранжевым до оранжевой окраски.
Пример расчета.
Навеска технического карбоната натрия 1, 7092 г растворена в мерной колбе 250 мл.
На титрование 20, 00 мл полученного раствора в присутствии фенолфталеина расходуется 10, 80 мл, а в присутствии метилового оранжевого - 21, 55 мл раствора HCl.
Вычислить процентное содержание Na2CO3 в образце, если T(HCl) = 0, 003640 г/мл.
| Дано: m н = 1, 7092 г T(HCl) = 0, 003640 г/мл Vк = 250, 00 мл Vn = 20, 00 мл V ф.ф. (HCl) = 10, 80 мл V м.о. (HCl) = 21, 55 мл |
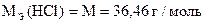
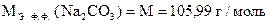
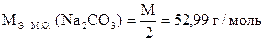
|
| w (Na2CO3) =? |
Решение:
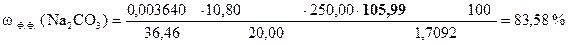
‚ ƒ „ … † ‡
| - | Сколько моль-экв HCl содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв HCl содержится в 10, 80 мл раствора. Столько же моль-экв Na2CO3 содержится в 20, 00 мл раствора. |
| ƒ - | Сколько моль-экв Na2CO3 содержится в 1 мл раствора. |
| „ - | Сколько моль-экв Na2CO3 содержится в 250, 00 мл раствора. |
| … - | Сколько г Na2CO3 содержится в 250, 00 мл раствора. Столько же г Na2CO3 содержится в навеске. |
| † - | Сколько г Na2CO3 содержится в 1 г образца. |
| ‡ - | Сколько г H3РO4 содержится в 100 г образца или w (Na2CO3). |
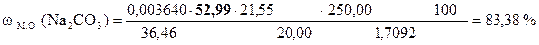
‚ ƒ „ … † ‡
| - | Сколько моль-экв HCl содержится в 1 мл раствора. Столько же моль-экв Na2CO3 эквивалентно 1 мл раствора HCl. |
| ‚ - | Сколько г Na2CO3 эквивалентно 1 мл раствора HCl или T(HCl/Na2CO3). |
| ƒ - | Сколько г Na2CO3 эквивалентно 21, 55 мл раствора HCl. Столько же г Na2CO3 содержится в 20, 00 мл раствора. |
| „ - | Сколько г Na2CO3 содержится в 1 мл раствора. |
| … - | Сколько г Na2CO3 содержится в 250, 00 мл раствора. Столько же г Na2CO3 содержится в навеске. |
| † - | Сколько г Na2CO3 содержится в 1 г образца. |
| ‡ - | Сколько г Na2CO3 содержится в 100 г образца или w (Na2CO3). |
9.10. Анализ каустической соды (NaOH + Na2CO3)
Каустической содой называют NaOH с примесью Na2CO3.
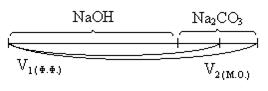
V1 = VHCl эквивалентный NaOH + 1/2 Na2CO3
V2 = VHCl эквивалентный NaOH + Na2CO3
(V2 - V1) = VHCl эквивалентный 1/2 Na2CO3
2 × (V2 - V1) = VHCl эквивалентный Na2CO3
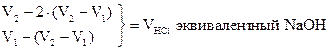
| Ф.Ф. | 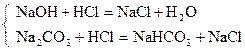
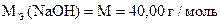
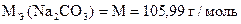
|
| М.О. | 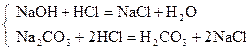
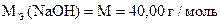
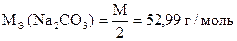
|
Способ титрования: прямой.
Способ взятия навески: пипетирование.
Индикатор: фенолфталеин и метиловый оранжевый.
Аликвоту раствора (объем пипетки) титруют стандартным раствором HCl с индикатором фенолфталеином до бледно-розовой окраски, а затем с метиловым оранжевым до оранжевой окраски.
Пример расчета.
Для анализа едкого натра, частично превратившегося под влиянием СО2 воздуха в соду, взято 0, 9184 г образца и растворено в мерной колбе 250 мл. На титрование 25, 00 мл полученного раствора в присутствии фенолфталеина расходуется 20, 70 мл, а в присутствии метилового оранжевого - 21, 48 мл 0, 1н раствора HCl (К = 1, 0420).
Вычислить процентное содержание NaOH и Na2CO3 в образце.
Дано:
m н = 0, 9184 г
К0, 1Н = 1, 0420
Vк = 250, 00 мл
Vn = 25, 00 мл
V ф.ф. (HCl) = 20, 70 мл
V м.о. (HCl) = 21, 48 мл
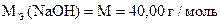
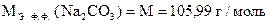
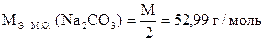
|
| w (NaOH) =? w (Na2CO3) =? |
Решение:
21, 48 - 20, 70 = 0, 78 мл - VHCl эквивалентный 1/2 Na2CO3
0, 78 × 2 = 1, 56 мл - VHCl эквивалентный Na2CO3
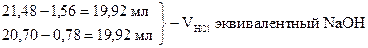
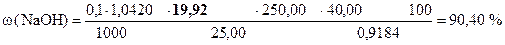
‚ ƒ „ … † ‡
| - | Сколько моль-экв HCl содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв HCl содержится в 19, 92 мл раствора. Столько же моль-экв NaOH содержится в 25, 00 мл раствора. |
| ƒ - | Сколько моль-экв NaOH содержится в 1 мл раствора. |
| „ - | Сколько моль-экв NaOH содержится в 250, 00 мл раствора. |
| … - | Сколько г NaOH содержится в 250, 00 мл раствора. Столько же г NaOH содержится в навеске. |
| † - | Сколько г NaOH содержится в 1 г образца. |
| ‡ - | Сколько г NaOH содержится в 100 г образца или w (NaOH). |
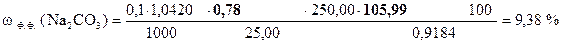
‚ ƒ „ … † ‡
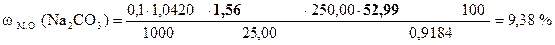
‚ ƒ „ … † ‡
| - | Сколько моль-экв HCl содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв HCl содержится в 0, 78 (1, 56) мл раствора. Столько же моль-экв Na2CO3 содержится в 25, 00 мл раствора. |
| ƒ - | Сколько моль-экв Na2CO3 содержится в 1 мл раствора. |
| „ - | Сколько моль-экв Na2CO3 содержится в 250, 00 мл раствора. |
| … - | Сколько г Na2CO3 содержится в 250, 00 мл раствора. Столько же г Na2CO3 содержится в навеске. |
| † - | Сколько г Na2CO3 содержится в 1 г образца. |
| ‡ - | Сколько г Na2CO3 содержится в 100 г образца или w (Na2CO3). |
9.11. Анализ кальцинированной соды (Na2CO3 + NaНCO3)
Кальцинированной содой называют Na2CO3 с примесью NaНCO3.
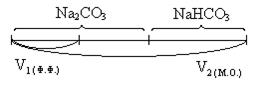
V1 = VHCl эквивалентный 1/2 Na2CO3
2V1 = VHCl эквивалентный Na2CO3
V2 - 2V1 = VHCl эквивалентный NaНCO3
| Ф.Ф. | Na2CO3 + HCl = NaHCO3 + NaCl
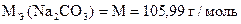
|
| М.О. | 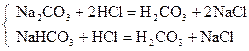
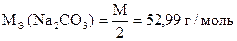
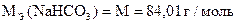
|
Способ титрования: прямой.
Способ взятия навески: пипетирование.
Индикатор: фенолфталеин и метиловый оранжевый.
Аликвоту раствора (объем пипетки) титруют стандартным раствором HCl с индикатором фенолфталеином до бледно-розовой окраски, а затем с метиловым оранжевым до оранжевой окраски.
Пример расчета.
Навеска соды 1, 0140 г, содержащая примесь гидрокарбоната натрия, растворена в мерной колбе 200 мл.
На титрование 20, 00 мл полученного раствора в присутствии фенолфталеина расходуется 8, 72 мл, а в присутствии метилового оранжевого – 18, 10 мл раствора HCl.
Т(HCl) = 0, 002920 г/мл.
Вычислить процентное содержание Na2CO3 и NaНCO3 в образце.
Дано:
m н = 1, 0140 г
Т(HCl) = 0, 002920 г/мл
Vк = 200, 00 мл
Vn = 20, 00 мл
V ф.ф. (HCl) = 8, 72 мл
V м.о. (HCl) = 18, 10 мл
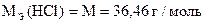
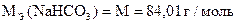
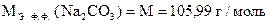
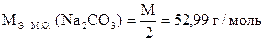
|
| w (Na2CO3) =? w (NaНCO3) =? |
Решение:
8, 72 мл - VHCl эквивалентный 1/2 Na2CO3
8, 72 × 2 = 17, 44 мл - VHCl эквивалентный Na2CO3
18, 10 - 17, 44 = 0, 66 мл - VHCl эквивалентный NaНCO3
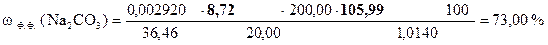
‚ ƒ „ … † ‡
| - | Сколько моль-экв HCl содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв HCl содержится в 8, 72 мл раствора. Столько же моль-экв Na2CO3 содержится в 20, 00 мл раствора. |
| ƒ - | Сколько моль-экв Na2CO3 содержится в 1 мл раствора. |
| „ - | Сколько моль-экв Na2CO3 содержится в 200, 00 мл раствора.. |
| … - | Сколько г Na2CO3 содержится в 200, 00 мл раствора. Столько же г Na2CO3 содержится в навеске. |
| † - | Сколько г Na2CO3 содержится в 1 г образца. |
| ‡ - | Сколько г Na2CO3 содержится в 100 г образца или w (Na2CO3). |
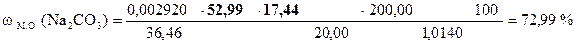
‚ ƒ „ … † ‡
| - | Сколько моль-экв HCl содержится в 1 мл раствора. Столько же моль-экв Na2CO3 эквивалентно 1 мл раствора HCl. |
| ‚ - | Сколько г Na2CO3 эквивалентно 1 мл раствора HCl или Т(HCl/Na2CO3). |
| ƒ - | Сколько г Na2CO3 эквивалентно 17, 44 мл раствора HCl. Столько же г Na2CO3 содержится в 20, 00 мл раствора. |
| „ - | Сколько г Na2CO3 содержится в 1 мл раствора. |
| … - | Сколько г Na2CO3 содержится в 200, 00 мл раствора. Столько же г Na2CO3 содержится в навеске. |
| † - | Сколько г Na2CO3 содержится в 1 г образца. |
| ‡ - | Сколько г Na2CO3 содержится в 100 г образца или w (Na2CO3). |
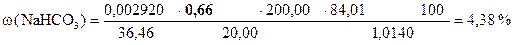
‚ ƒ „ … † ‡
| - | Сколько моль-экв HCl содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв HCl содержится в 0, 66 мл раствора. Столько же моль-экв NaНCO3 содержится в 20, 00 мл раствора. |
| ƒ - | Сколько моль-экв NaНCO3 содержится в 1 мл раствора. |
| „ - | Сколько моль-экв NaНCO3 содержится в 200, 00 мл раствора. |
| … - | Сколько г NaНCO3 содержится в 200, 00 мл раствора. Столько же г NaНCO3 содержится в навеске. |
| † - | Сколько г NaНCO3содержится в 1 г образца. |
| ‡ - | Сколько г NaНCO3содержится в 100 г образца или w (NaНCO3). |