
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролизом называется взаимодействие ионов соли с Н2О, приводящее к образованию слабого электролита.
|
|
ГИДРОЛИЗ СОЛЕЙ
Любую соль можно представить как продукт взаимодействия кислоты и основания.
В зависимости от видов этих исходных веществ выделяют 4 типа солей.
1. Соли, образованные сильной кислотой и сильным основанием:
NaOH + HCl = NaCl + H2O
сильное сильная
основание кислота
2 KOH + H2SO4 = K2SO4 + 2 H2O
сильное сильная
основание кислота
Такие соли гидролизу не подвергаются и их водные растворы имеют нейтральную среду.
2. Соли, образованные слабой кислотой, но сильным основанием:
H2CO3 + 2 NaOH = Na2СO3 + 2 H2O
слабая сильное
кислота основание
H2S + 2 KOH = K2S + 2 H2O
слабая сильное
кислота основание
В водных растворах таких солей с H2O будут взаимодействовать анионы слабой кислоты, которые образуются при диссоциации соли:
Na2СO3 ® 2 Na + + CO3 2−
Эти анионы будут присоединять к себе ионы Н+, отщепившиеся от молекул H2O, в результате этого образуется слабый электролит HСO3− - гидрокарбонат-анион, а в растворе станут накапливаться ионы ОН− , которые будут сообщать раствору такой соли щелочную реакцию.
HOH + CO32- 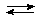 HСO3 − + OH –
HСO3 − + OH –
В результате этого рН растворов солей, образованных слабой кислотой и сильным основанием, будет > 7. А в самом растворе станут присутствовать кислая соль и щелочь.
В молекулярном виде уравнение гидролиза записывается следующим образом:
Na2СO3 + НОН 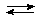 NaHСO3 + NaOH
NaHСO3 + NaOH
Взаимодействие ионов соли с H2O является обратимой реакцией и с течением времени в растворе устанавливается равновесие и при этом гидролизу подвергается только малая часть анионов соли. Чем слабее кислота, образующая соль, тем сильнее протекает гидролиз.
Если соль образована слабой многоосновной кислотой, то гидролиз может идти в несколько стадий или ступеней. Их число равно величине заряда анионов слабой кислоты. Например:
|
НОН + S2 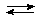 HS- + OH-
HS- + OH-
молекулярное Na2S + НОН 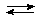 NaНS + NaОН
NaНS + NaОН
уравнение:
|
НS- + НОН 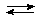 Н2 S + ОН-
Н2 S + ОН-
молекулярное NaНS + НОН 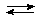 Н2 S + NaОН
Н2 S + NaОН