
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретические основы.
|
|
АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра органической, био-
логической и физколлоидной
химии.
ФИЗИЧЕСКАЯ ХИМИЯ
Методические указания к лабораторному практикуму
по теме " Коагуляция" для студентов специальности
Quot; Технология рыбных продуктов".
АСТРАХАНЬ 1991 г.
I. ЦЕЛЬ РАБОТЫ.
Изучить коагуляцию коллоидных растворов (золей) электролитами:
I.I. Определить пороги коагуляции золей различными солями.
I.2. Определить влияние валентности коагулирующих ионов на порог
коагуляции и сравнить с правилом Щульце-Гарди.
I.3. Определить защитное число золя.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ.
2.1. Понятие об устойчивости дисперсных систем.
В водоемах и при технологической обработке рыбных продуктов могут быть растворы различной степени дисперсности: от ионодисперсных до коллоиднодисперсных.
Отличительным признаком коллоиднодисперсных систем от молекулярно- и ионодисперсных является их относительно малая устойчивость и гетерогенность.
Под устойчивостью дисперсных систем понимают постоянство их свойств от времени, постоянство дисперсности, постоянство распределения частиц по объему дисперсной фазы, постоянство межчастичного взаимодействия.
Укрупнение частиц, осаждение их свидетельствует о нарушении устойчивости (стабильности) системы (раствора).
По предложению Н. Н. Пескова устойчивость дисперсных систем подразделяют на два вида:
а) устойчивость к осаждению дисперсной фазы (седиментационная устойчивость);
б) устойчивость к агрегации частиц (агрегативная устойчивость).
Агрегативная утойчивость может быть термодинамической и кинетической.
Термодинамически устойчивые дисперсионные системы образуются в результате самопроизвольного диспергирования одной из фаз. По классификации П. А. Ребиндера термодинамически устойчивые системы называют лиофильными.
Лиофобными называют термодинамически неустойчивые системы. Кинетическая устойчивость дисперсных систем зависит от времени.
Большинство дисперсных систем обладает избытком поверхностной энергии, и поэтому в них самопроизвольно идут процессы укрупнения частиц - происходит снижение поверхностной энергии за счет уменьшения удельной поверхности. Такие системы называют агрегативно-неустойчивыми. Процесс укрупнения частиц называют коагуляцией (от латинского coagulatie - свертывание, отвораживание).
В общем смысле под коагуляцией понимают потери агрегативной устойчивости дисперсной системы.
В более узком смысле коагуляцией называют слипание частиц (рис. 2.1.1.). Слияние частиц называют коалесценцией (рис. 2.1.2.).
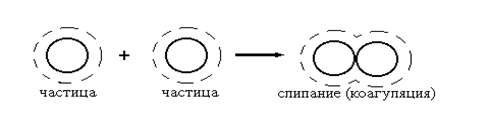
Рис. 2.1.1. Схема коагуляции частиц (штрихами обозначена
гидратная - сольватная - оболочка).

Рис. 2.1.2. Схема коалесценции частиц.
Обратный процесс образования устойчивой дисперсной системы из осадка или геля (структурированной дисперсной системы) называют пептизацией (рис. 2.1.3. а, б)
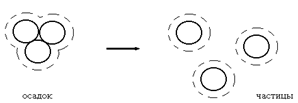
| 
|
а) б)
Рис. 2.1.3. Схема пептизации осадка (а) и геля (б).
2.2. Коагуляция дисперсных систем.
Коагуляция дисперсных систем может произойти под действием различных факторов:
а) при длительном диализе;
б) при добавлении электролитов;
в) при добавлении неэлектролитов;
г) при механическом воздействии (размешивание, встряхивание);
д) при охлаждении и нагревании;
е) при пропускании электрического тока;
ж) под действием лучистой энергии.
Иногда коагуляция происходит в результате химических изменений, протекающих в золе (старение).
Во всех случаях причиной коагуляции является уменьшение связи частиц с окружающей их дисперсионной средой.
Главным условием устойчивости раствора является его электрический заряд. Основным методом коагуляции золей является различные приемы снятия их зарядов. Чаще всего для этой цели пользуются воздействием электролитов на коллоидный раствор.
2.3. Возникновение потенциалов в мицеллах золей.
Мицеллы золей, полученных методом химической конденсации, имеют кристаллическое ядро. Ионы, находящиеся на концах кристаллической решетки, обладают ненасыщенными валентностями и за счет имеющегося адсорбционного поля к осадку приближаются ионы, способные достроить кристаллическую решетку. В результате на поверхности кристалла появляется потенциал, называемый термодинамическим потенциалом j.
Например, к осадку золя сернокислого бария, стабилизированного хлоридом бария, в первую очередь подойдут ионы бария, так как осадок содержит в своем составе ионы бария. Ионы бария, адсорбированные на поверхности ядра, создадут термодинамический потенциал j (рис. 2.3.1.).
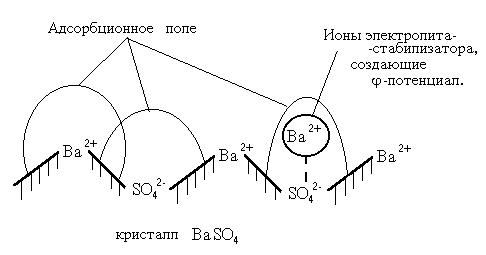 Рис. 2.3.1. Схема возникновения термодинамического потенциала.
Рис. 2.3.1. Схема возникновения термодинамического потенциала.
Таким образом, на поверхности ядра появился заряд. Для нейтрализации этого заряда из раствора электролита в адсорбционное поле попадают ионы противоположного заряда. Часть этих ионов находится вне адсорбционного поля. Ионы электролита, попадая в адсорбционное поле (в данном случае ионы Cl-), создают еще один термодинамический потенциал j1 (рис. 2.3.2.).
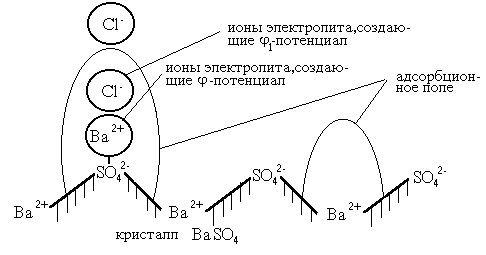
Рис. 2.3.2. Схема возникновения термодинамических потенциалов j и j1.
Ядро мицеллы и адсорбированные на нем ионы прочно связаны. Они образуют гранулу. Если j-потенциал не нейтрализован полностью j1-потенциа-лом, то на поверхности гранулы появляется электрокинетический потенциал, называемый дзета-потенциал (z-потенциал). Отсюда следует, что
z = j1 - j1 (2.3.1.) 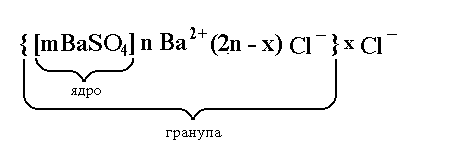
Рис. 2.3.3. Схема строения мицеллы золя сернокислого бария,
стабилизированного хлоридом бария, с распреде-
лением потенциалов на поверхности ядра.
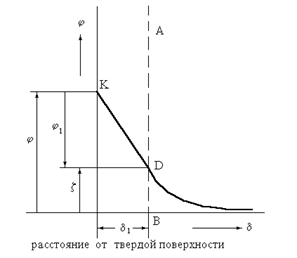
Электрический z-потенциал возникает на определенном расстоянии d1 от твердой поверхности (от ядра). Схема распределения зарядов и падения потенциалов представлена на рис. 2.3.4. (а, б).
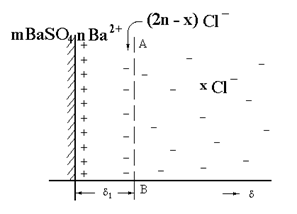
| 
|
а) б)
Рис. 2.3.4. Схема распределения зарядов (а) и падения
потенциалов (б) в мицелле золя сернокислого
бария, стабилизированного хлоридом бария.
Потенциалы j и z имеют один знак заряда, а j1 - противоположный. Падение потенциала j до плоскости скольжения АВ происходит линейно, так как ионы в этом слое адсорбционно (прочно) связаны с ядром мицеллы (осадком).
После плоскости АВ падение потенциала происходит криволинейно, асимптически приближаясь к оси абсцисс.
Плоскость скольжения АВ возникает на границе адсорбционный слой противоионов/диффузный слой противоионов. На схеме строения мицеллы показана плоскость скольжения (рис. 2.3.5.).
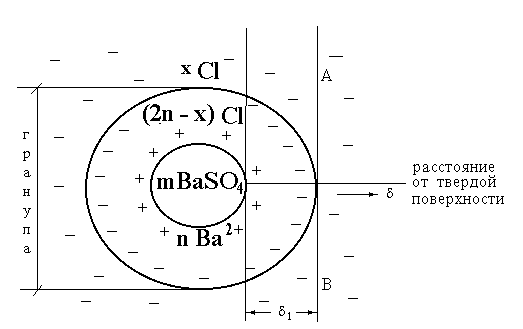
Рис. 2.3.5. Схема строения мицеллы золя сернокислого бария,
стабилизированного хлоридом бария. АВ - плоскость скольжения.
2.4. Влияние электролитов на электрокинетический z-потенциал.
По отношению к коллоидному раствору (золю) все электролиты условно можно подразделить на:
1. неиндефферентные-электролиты, содержащие в своем составе ионы ядра мицеллы;
2. индифферентные-электролиты, не содержащие в своем составе ионов ядра мицеллы.
Рассмотрим влияние электролитов на золь сернокислого бария, стабилизированный хлоридом бария:
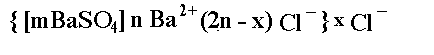
По отношению к данному золю существует две группы неиндифферентных-электролитов: одна группа содержит ионы Ва2+ (а), а другая - ионы SO42-(б). Электролиты должны быть растворены в воде. Сведения о растворимости представлены в таблице 2.4.1.
Таким образом, неиндифферентными электролитами для золя сернокислого бария будут следующие:
1, а: Ba (OH)2, Ba Br2, Ba J2, Ba S, Ba (NO3)2, (CH3COO)2 Ba.
1, б: H2 SO4, K2 SO4, Na2 SO4, (NH4)2 SO4, Mg SO4, Al2 (SO4)3, Cr2 (SO4)3, Fe SO4, Fe2(SO4)3, Ni SO4, Mn SO4, Zn SO4, Hg SO4, Sn SO4, Cu SO4, Li2 SO4, Co SO4.
При изучении влияния неиндифферентных электролитов на золь будем обращать внимание на действие только одного иона электролита.
Индифферентными по отношению к золю сернокислого бария могут быть электролиты двух типов:
2, а: электролиты, содержащие ионы мицеллы. В данном случае это – электролиты, содержащие ионы Cl- и растворимые в воде:
H Cl, K Cl, Na Cl, NH4 Cl, Ca Cl2, Mg Cl2, Al Cl3, Cr Cl3, Fe Cl2, Fe Cl3, Ni Cl2,
Таблица 2.4.1.
Общие сведения о растворимости кислот, оснований и солей в воде.
| Название | Анионы | Катионы | ||||||||||
| соединений | H+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | |
| гидроксид | OH- | Р | Р | Р | Р | М | Н | Н | Н | Н | Н | |
| хлорид | Cl- | р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| бромид | Br- | р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| иодид | J- | р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Г |
| сульфид | S2- | Р | Р | Р | Р | Р | М | М | Г | Г | Н | Н |
| сульфит | SO32- | Р | Р | Р | Р | Н | Н | Н | - | - | Н | - |
| сульфат | SO42- | Р | Р | Р | Р | Н | Н | Р | Р | Р | Р | Р |
| фосфат | PO43- | Р | Р | Р | Р | Н | Н | Н | Н | Н | М | М |
| карбонат | CO32- | Р | Р | Р | Р | Н | Н | Н | - | - | Н | - |
| силикат | SiO32- | Н | Р | Р | - | Н | Н | Г | Г | Г | Г | Г |
| нитрат | NO3- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| ацетат | CH3COO- | Р | Р | Р | Р | Р | Р | Р | М | Р | Р | Р |
Продолжение таблицы 2.4.1.
| Название | Анионы | Катионы | ||||||||||
| соединений | Ni2+ | Mn2+ | Zn2+ | Ag+ | Hg+ | Hg2+ | Pb2+ | Sn 2+ | Cu2+ | Li+ | Co2+ | |
| гидроксид | OH- | Н | Н | Н | - | - | - | Н | Н | Н | Р | Н |
| хлорид | Cl- | Р | Р | Р | Н | Н | Р | Мо | Р | Р | Р | Р |
| бромид | Br- | Р | Р | Р | Н | Н | М | Мо | Р | Р | Р | Р |
| иодид | J- | Р | Р | Р | Н | Н | Н | Но | М | - | Р | Р |
| сульфид | S2- | Н | Н | Н | Н | Н | Н | Н | Н | Н | Р | Н |
| сульфит | SO32- | Н | Н | Н | Н | - | - | Н | - | Г | Р | Р |
| сульфат | SO42- | Р | Р | Р | М | М | Р | Н | Р | Р | Р | Р |
| фосфат | PO43- | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| карбонат | CO32- | Н | Н | Н | Н | Н | - | Н | Г | Г | Р | Н |
| силикат | SiO32- | Г | Г | Г | - | - | - | Г | Г | Г | Р | - |
| нитрат | NO3- | Р | Р | Р | Р | Р | Р | Р | Г | Р | Р | Р |
| ацетат | CH3COO- | Р | Р | Р | Р | М | Р | Р | Р | Р | Р | Р |
Примечания: Для определения растворимости того или иного соединения надо найти в верхней строчке обозначение обозначение соответствующего катиона, а влевом столбце – аниона, провести от катиона вниз вертикальную линию, а от аниона вправо – горизонтальную до их пересечения. По обозначению на пересечении линий определите, растворимо вещество или нет.
Обозначения: «Н» – нерастворимо; «М» - малорастворимо; «Г» - вещество вследствие гидролиза в растворе плучить нельзя; «-» – вещество до настоящего времени не получено; «Р» - вещество летучее или распадается с образованием газа; «Но» или «Мо» - растворимость вещества повышается при нагревании раствора.
Mn Cl2, Zn Cl2, Hg Cl2, Sn Cl2, Cu Cl2, Li Cl, Co Cl2.
2, б: электролиты, не содержащие ионов мицеллы: KNO3 , CH3COOAg, Na3PO4 и т. д.
 |
2.4.1. Влияние на золь сернокислого бария стабилизированного хлоридом бария,
электролитов группы 1, а (например, BaBr2):
Из этих двух ионов более энергично должен проявлять себя ион Ba2+, т. к. он способен достраивать кристаллическую решетку. И если на концах кристаллической решетки есть адсорбционные поля, созданные ионами SO42-, свободные, не занятые ионами (Ba2+) электролита-стабилизатора, то ионы Ba2+ электролита, добавленного к золю, будут адсорбироваться на поверхности ядра. Таким образом, на поверхности ядра увеличится количество ионов Ba2+ , допустим, на p штук. Мицелла примет вид:
j¢ j¢ 1 = const z¢
{ [m BaSO4] (n+p) Ba2+ (2n – x) Cl- } * Cl-
Увеличение ионов Ba2+ в адсорбционном слое повысит термодинамический потенциал с j до j¢. При неизменном термодинамическом потенциале j1 = j¢ 1 электрокинетический потенциал увеличится с z до z¢, так как
z = j1 - j1 (2.3.1.).
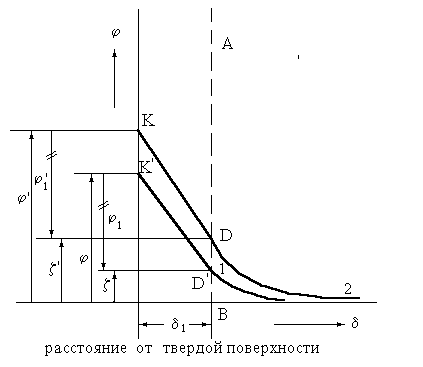 |
Происходящие в мицелле изменения изображены на рис. 2.4.1.1.
Рис. 2.4.1.1. Изменение потенциалов при действии электролитов группы 1, а на золь сернокислого бария: 1 – исходный золь, 2 – золь после добавления электролита., содержащего такие же ионы, как и потенциопределяющие.
|