
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ход работы. Опыт №1. Среда водных растворов солей.
|
|
Опыт №1. Среда водных растворов солей.
В отдельные пробирки наливаю по 3-4 капли растворов хлорида железа (III), сульфата цинка, сульфата алюминия, карбоната натрия и сульфида натрия. Добавляю по 1-2 капли лакмуса и записываю в таблицу окраску каждого из растворов этих солей. Выливаю содержимое пробирок, промываю их дистилированной водой и вновь наливаю указанные выше растворы. Добавляю по 1-2 капли фенолфталеина и записываю окраску растворов.
| № | Формула | Окраска лакмуса | Окраска фенолфталеина | Среда |
| FeCl3 | Красный | Бесцветный | Кислая | |
| ZnSO4 | Красный | Бесцветный | Кислая | |
| Al2(SO4) | Красный | Бесцветный | Кислая | |
| Na2CO3 | Синий | Малиновый | Щелочная | |
| Na2S | Темно-синий | Малиновый | Щелочная |
1. 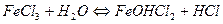
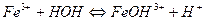
2. 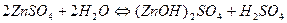
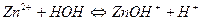
3. 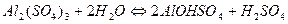
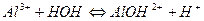
4. 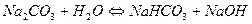
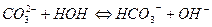
5. 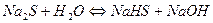
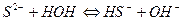
Опыт №4. Взаимное усиление гидролиза при взаимодействии растворов солей.
1).
2FeCl3 + 3NaCO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
2Fe3+ + 6Cl- + 6Na+ + CO32- + 3HOH → 2Fe(OH)3↓ + 6Na+ + 6Cl- +3CO2↑
2Fe3+ + CO32- + 3HOH → 2Fe(OH)3↓ + 3CO2↑
2).
Al2(SO4)3 + 3Na2CO3 + 6H2O → 2Al(OH)3↓ + 3Na2SO4 + 3H2O + 3CO2↑
2Al3+ +3SO4 + 6Na+ + 3CO22- + 6HOH → 2Al(OH)3↓ + 6Na+ + 3SO42- + 3CO2↓ + 3HOH
2Al3+ + 3CO2 + 3HOH → 2Al(OH)3↓ + 3CO2↑
3).
Cr(SO4)3 + Na2S + 6H2O → 3H2S↑ + 2Cr(OH)3↓ + 3Na2SO4
2Cr3+ + 3SO4 + 6Na+ + 3S2- + 6HOH → 3H2S↑ + 6Na+ + 3SO42- + 2Cr(OH)3↓
2Cr3+ + 3S2- +6HOH → 3H2S↑ + 2Cr(OH)3↓
Вывод: в ходе проведения лабораторной работы, мы ознакомились с процессом гидролиза и его следствиями, а также научились составлять уравнения гидролиза.