
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фенольный процесс
|
|
Исторически первым процессом производства капролактама был процесс, использующий в качестве исходного сырья фенол. На первой стадии в этом процессе фенол гидрируется до циклогексанола над катализатором Pd/Al2O3 или Ni-Cr/Al2O3 при 120-140 °C и давлении 1-1, 5 МПа либо 130-150 °C и 1, 5-2, 5 МПа соответственно:
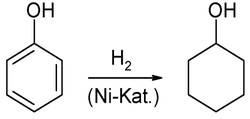
Циклогексанол затем дегидрируется до циклогексанона (1), из которого затем реакцией с избытком водного раствора сульфата гидроксиламина в присутствии щелочи или аммиака при 0-100 °C получают циклогексаноноксим (2) и далее перегруппировкой Бекмана капролактам (3):

18. Ароматические углеводороды. Особенности электронного строения молекулы бензола и его химического поведения. Энергия резонанса. Понятие «ароматичности» и правило Хюккеля. Способы получения бензола и его гомологов. Номенклатура и изомерия производных бензола. Ряды функциональных производных.
Соединения, которые содержат циклические сопряженные П-электрон-ные системы, удовлетворяющие критериям ароматичности, в органической химии принято называть ароматическими соединениями. Эти соединения отличаются исключительным своеобразием как своих структурных характеристик, так и реакционной способности. Первым представителем ароматических соединений является бензол.

Каждый атом углерода находится в состоянии sp2-гибридизации. Три sp2-орбитали С-атома лежат в плоскости молекулы и образуют σ -связи с двумя соседними С-атомами и атомом водорода. Каждый атом углерода имеет также одну негибридизованную 2pz-орбиталь. Эти орбитали перпендикулярны плоскости молекулы. При перекрывании этих орбиталей формируется ρ -электронное облако бензола.
Для бензола характерно: 1) реакция замещения, 2)высокая устойчивость к окислению, 3) высокая термическая устойчивость.
Энергия резонанса. Молекула бензола более устойчивая по сравнения со структурой ЦГТ.
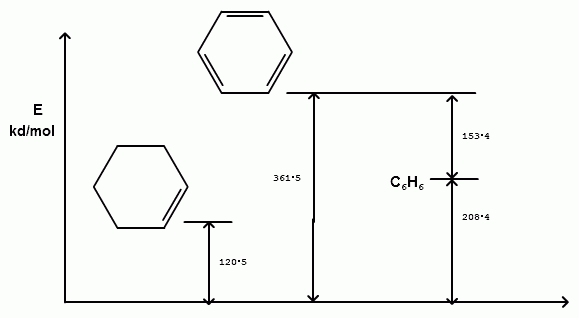
Ренгенно-структурный анализ, молекула бензола плоский 6-и угольник.
Длина связи С=С -1, 39 А, С-Н – 1, 09, валентный угол L =120°.Все атомы углерода и водорода равноценны.
К настоящему времени установлено, что ароматичность как особое химическое качество характерна не только для бензола. Существуют соединения, не относящиеся к ряду бензола, но также обладающие ароматическими свойствами.
Известно несколько правил (критериев) ароматичности. Наиболее распространенное определение ароматичности принадлежит Э. Хюккелю. В 1930 г. на основе расчетов простым квантово-химическим методом Хюккель сформулировал следующее правило ароматичности:
плоские моноциклические соединения, содержащие замкнутую сопряженную систему (4п + 2) п- электронов, где п - 0, 1, 2, 3... (т. е. соединения, содержащие 2, 6, 10, 14 п-электронов в цикле), являются ароматическими. Соединения, содержащие 4п п-электронов в такой сопряженной системе, являются антиароматическими. Соединения, в которых отсутствует система сопряженных двойных связей, называют неароматическими.
Это правило называют также правилом Хюккеля.
Способы получения бензола.
1.из природных соединений
С→ коксов. газ→ бензол., смолы→ фенолы.
Эфир масла растений- ароматические кетоны, кислоты, эфиры.
2.ароматизация алканов.
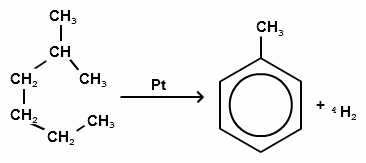
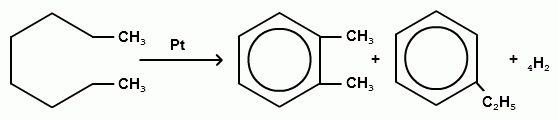
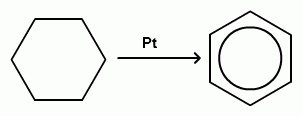

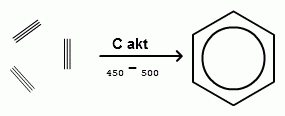
3. Циклическая протоновая конденсация.
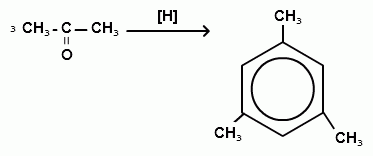
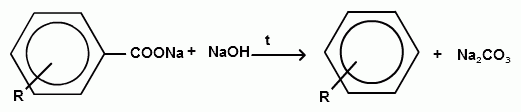

Номенклатура и изомерия.

19. Химические свойства бензола (реакции присоединения, окисления, замещения.) Механизм реакций электрофильного замещения. Особенности реакций сульфирования, понятие о кинетическом изотопном эффекте. Энергетическая диаграмма реакции электрофильного замещения, π - и σ -комплексы.
Химические свойства бензола.
1.Реакция присоединения. 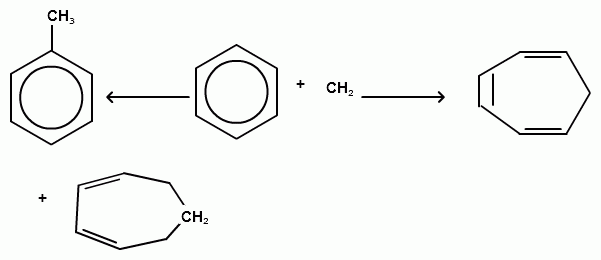
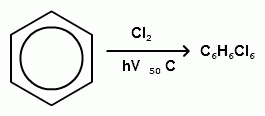
Реакция замещения.
1) Детрирование, дейтрированнаяH2SO4
2) нитрование HNO3+H2SO4
3) галагенированиеX2, FeX3
4) Сульфирование H2SO4
5)алкилированиеRX, AlCl3
6) ацелирование (R=R-CO-)
Окисление бензола.


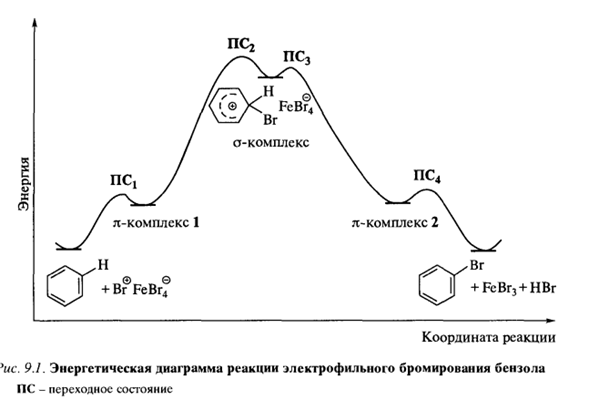
Реакция сульфирования отличается небольшим кинетическим изотопным эффектом, ku/kD = 2. Этот факт, по-видимому, объясняется большей / стабильностью соответствующего промежуточного σ -комплекса. σ -комплекс в этой реакции представляет собой биполярный ион, в котором скомпенсированы положительный и отрицательный заряды. Тем самым стадия отщепления протона от такого σ -комплекса несколько замедляется.
Кинетический изотопный эффект (КИЭ) измеряют как отношение константы скорости реакции обычного соединения к константе скорости реакции аналогичного соединения, но содержащего иной изотоп замещаемого атома, например: kH/kD; kH/kT; kl2c/kl4c
Для веществ, меченных дейтерием или тритием, различие в скоростях реакций по сравнению с соединениями, содержащими протий, особенно велико вследствие большого различия в массах этих изотопов (1: 2 или 1: 3). В тех случаях, когда ku/kD или kH/kT равно 10-20, говорят, что кинетический изотопный эффект наблюдается.
Наличие КИЭ указывает на то, что стадия разрыва связи С-Н (стадия 4), по крайней мере частично, влияет на скорость всей реакции.В тех случаях, когда kH/kD или кп/кТ равно 1, говорят, что кинетический изотопный эффект отсутствует. В этих реакциях стадия образования σ - комплекса является скоростью лимитирующей. Многие реакции электро-фильного замещения в ароматическом ряду не обнаруживают кинетического изотопного эффекта.
|