
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение задач на pH
|
|
Пример задания (фрагмент табл.1):
| Номер варианта | Номера задач | |||||||
| рН | pOH | c 1 | c 2 | V 1 | V 2 | c | Ka | |
| пример | 2, 4 | 10, 9 | 0, 023 | 0, 032 | 0, 034 | 4, 3·10− 6 |
1. Определение среды раствора по значению рН
| рН | ОБЩИЙ ВИД | ПРИМЕР | |
| > 7 | < 7 | рН = 2, 4 < 7 | |
| Среда раствора | щелочная | кислая | кислая |
а) Расчет молярной концентрации: а) ионов Н+; б) ионов ОН−
| ОБЩИЙ ВИД | ПРИМЕР | |
| а) | [H+] = 10− pH моль/л | [H+] = 10–2, 4 = 4, 0∙ 10 – 3 моль/л |
| б) | [OH–] = 10pH – 14 моль/л | [OH–] = 102, 4 – 14 = 2, 5∙ 10–12 моль/л |
в) Расчет молярной концентрации HCl (если среда кислая) или NaOH (если среда щелочная)
| ОБЩИЙ ВИД | ПРИМЕР | ||
| Среда раствора | кислая | щелочная | кислая |
| c (HCl) или c (NaOH), моль/л | c (HCl) = [H+] | c (NaOH) = [OH–] | c (HCl) = 4, 0∙ 10 – 3 |
2. Определение среды раствора по значению рOН
| рOН | ОБЩИЙ ВИД | ПРИМЕР | |
| < 7 | > 7 | рOН = 10, 9 > 7 | |
| Среда раствора | щелочная | кислая | кислая |
а) Расчет молярной концентрации: а) ионов Н+; б) ионов ОН−
| ОБЩИЙ ВИД | ПРИМЕР | |
| а) | [H+] = 10pOH – 14 моль/л | [H+] = 1010, 9 – 14 = 7, 9∙ 10–4 моль/л[ |
| б) | [OH–] = 10− pOH моль/л | [OH–] = 10 – 10, 9 = 1, 3∙ 10 – 11 моль/л |
в) Расчет молярной концентрации HCl (если среда кислая) или NaOH (если среда щелочная)
| ОБЩИЙ ВИД | ПРИМЕР | ||
| Среда раствора | кислая | щелочная | кислая |
| c, моль/л | c (HCl) = [H+] | c (NaOH) = [OH–] | c (HCl) = 7, 9∙ 10–4 |
3. Нахождение рН и pOH c 1 М раствора H2SO4 (у равнение диссоциации: H2SO4 → 2 H+ + SO 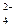 )
)
| ОБЩИЙ ВИД | ПРИМЕР |
| [H+] = 2 c 1 моль/л | [H+] = 2·0, 023 = 0, 046 моль/л |
| pH = –lg[H+]; pOH = 14 – рН | pH = –lg0, 046 = 1, 337; pOH = 14 – 1, 337 = 12, 663 |
4. Нахождение рН и pOH c 2 М раствора Ba(OH)2 (у равнение диссоциации: Ba(OH)2 → Ba2+ + 2OH− )
| ОБЩИЙ ВИД | ПРИМЕР |
| [OH–] = 2 c 2 моль/л | [OH–] = 2·0, 032 = 0, 064 моль/л |
| pOH = –lg[OH–]; pH = 14 – рOН | pOH = –lg0, 064 = 1, 194; pH = 14 – 1, 194 = 12, 806 |
5. Нахождение рН раствора, полученного при смешении V 1 мл c 1 М раствора H2SO4 и
V 2 мл c 2 М раствора Ba(OH)2 (уравнение реакции: H+ + OH− = H2O)
| ОБЩИЙ ВИД | ПРИМЕР | ||
| n 0(H+) = [H+] V 1 ммоль n 0(OH− ) = [OH− ] V 2 ммоль | n 0(H+) = 0, 046·22 = 1, 012 ммоль n 0(OH− ) = 0, 064·64 = 4, 096 ммоль | ||
| n 0(H+) > n 0(OH–) | n 0(H+) < n 0(OH–) | n 0(H+) = n 0(OH–) | n 0(H+) = 1, 012< n 0(OH− ) = 4, 096 |
n (H+) = n 0(H+) – n 0(OH− ), 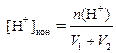 моль/л,
рН = –lg[H+]кон моль/л,
рН = –lg[H+]кон
| n (OH− ) = n 0(OH− ) – n 0(H+),
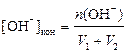 моль/л,
рН = 14 + lg[OH− ]кон моль/л,
рН = 14 + lg[OH− ]кон
| рН = 7 | n (OH− ) = 4, 096 –1, 012= 3, 084 ммоль,
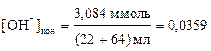 моль/л,
рН = 14 + lg0, 0359 = 12, 56 моль/л,
рН = 14 + lg0, 0359 = 12, 56
|
6. Нахождение [H+], рН и pOH в c М растворе слабой кислоты, константа диссоциации которой равна Ka
| ОБЩИЙ ВИД | ПРИМЕР |
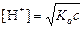 моль/л;
pH = –lg[H+]; pOH = 14 – рН моль/л;
pH = –lg[H+]; pOH = 14 – рН
| 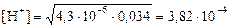 моль/л;
pH = –lg(3, 82·10–4) = 3, 42; pOH = 14 – 3, 42 = 10, 58 моль/л;
pH = –lg(3, 82·10–4) = 3, 42; pOH = 14 – 3, 42 = 10, 58
|