
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Применение схем пролонгированной контрацепции с лечебной целью
|
|
Эндометриоз
Эндометриоз проявляется болями в области малого таза, менометроррагией, дисменореей, диспареунией, бесплодием. Клинические проявления при эндометриозе во многом зависят от уровня эстрогенов, поэтому подавление выработки сте-роидов яичниками приводит к уменьшению выраженности симптомов. В эндометриоидной ткани снижена экспрессия, 17р-гидроксистероиддегидрогеназы 2-го типа, преобразующей эстрадиол в эстрон, но не участвующей в метаболизме этинил-эстрадиола (Guillebaud J., 1987).
Подавление синтеза эстрогенов в яичниках под действием пероральных контрацептивов может снижать в тканях эстроген-ное влияние, поскольку этинилэстрадиол стимулирует пролиферацию слабее, чем эстрадиол (Wiegratz L., Kuhl H., 2004). Непрерывное лечение комбинированным препаратом, содержащим 20 мкг этинилэстрадиола и 150 мкг дезогестрела, при рецидивирующих болях в области таза, после хирургического лече-ния эндометриоза, сопровождавшегося клиническими проявлениями, приводило к значительному снижению выраженности дисменореи (Wiegratz L. et al., 2004), диспареунии, а также к по-вышению качества жизни и степени сексуальной удовлетворенности пациенток. Предполагают, что прогрессирование эндометриоза на фоне терапии пероральными контрацептивами пo-давляется, но после прекращения лечения его клинические проявления могут рецидивировать (Park В.К. et al., 1996). Поэтому непрерывные схемы с продленным циклом приема пероральных контрацептивов при эндометриозе представляются весьма перспективными и интересными для дальнейшего изучения.
Лейомиома матки
У многих больных лейомиома матки не сопровождается клиническими симптомами, но в части случаев она может сот провождаться болями и меннорагиями. Показано, что во время приема пероральных контрацептивов риск развития лейо-миом матки снижается; эти данные были подтверждены pe-зультатами ультразвукового исследования и результатами гистерэктомии (Marshall L.M. et al., 1997). При лейомиомах матки

|
лечение пероральными контрацептивами не оказывало статистически значимого влияния на размер или объем полости матки, но снижало продолжительность менструальных кровотечений и повышало показатель гематокрита (Friedman A.J., Thomas P.P., 1995). Однако для оценки эффективности и безопасности непрерывного приема пероральных контрацептивов при лейомиомах матки необходимо проведение проспективных рандомизированных клинических исследований.
Синдром поликистозных яичников (СПКЯ)
При СПКЯ непрерывное лечение монофазными пероральными контрацептивами вызывает более выраженное подавление выработки андрогенов в яичниках, чем стандартные схемы лечения, и благодаря этому может оказывать при заболеваниях, связанных с гиперпродукцией андрогенов, более выраженный терапевтический эффект (Ruchhoft E. et al., 1996). Во время приема пероральных контрацептивов по обычным схемам синтез андрогенов во время интервалов отмены может вновь повышаться (Kuhl H. et al., 1985; Kistner R.W., 1956).
В небольшом исследовании больных с СПКЯ было показано, что обычная схема комбинированного лечения этинилэст-радиолом по 30 мкг и дезогестрелом по 150 мкг приводила к статистически значимому снижению уровней Л Г и тестостерона, исчезавшему во время интервалов отмены гормонов. В отличие от этого, непрерывный прием в течение 3 мес. без 7-дневных перерывов вызывал выраженное и стойкое снижение ЛГ и тестостерона. Это влияние было сопоставлено с результатами ежемесячного введения депонированных агонис-тов ГнРГ (Ruchhoft E. et al., 1996). Хотя пероральные контрацептивы считают традиционным методом длительной терапии СПКЯ, данных об индуцируемых ими опасностях для здоровья пациенток все еще недостаточно. Требуется проведение дополнительных исследований для оценки длительного влияния пероральных контрацептивов на обмен веществ, учитывая возможность сочетания СПКЯ с различными факторами риска заболеваний сердечно-сосудистой системы.
Недостаток железа и железодефицитная анемия Недостаток железа выявляется почти у 10% молодых женщин, а железодефицитная анемия у 2, 2%, причем доля женщин с недостатком железа коррелирует с выраженностью и продолжительностью менструаций (Milman N. et al., 1998). Как при недостатке железа, так и при железодефицитной анемии, снижение частоты и интенсивности менструаций или кровотечений «отмены» может улучшить общее клиническое состояние пациенток.

|
Поэтому при патологических маточных кровотечениях после исключения органических причин заболевания могут быть рекомендованы схемы с продленным циклом применения перораль-ных контрацептивов (Chuong C.J., Brenner P.F. et al., 1996).
Предменструальный синдром и дисменорея Почти 30% фертильных женщин предъявляют жалобы на боли внизу живота и в молочных железах, отечность, депрессивные состояния, повышенную раздражительность, проявляющиеся в полной мере во вторую фазу менструального цикла и исчезающих в течение менструации (Svemdottir H., Backstrom T.J 2000). Во время применения пероральных контрацептивов в соответствии со стандартной схемой «21/7» клинические проявления развиваются чаще во время 7-дневных интервалов отмены гормонов, чем в течение 21-дневных циклов приема гормональных препаратов (Oinonen K.A., Mazmanian D., 2002). В ряде исследований показано, что непрерывное и равномерное влияние половых стероидов приводит к уменьшению клинических проявлений, вызванных отменой КОК: 74% женщин отметили уменьшение симптомов, связанных с отменой гормонов. Расширенную схему приема пероральных контрацептивов продолжила в течение 5 лет почти половина женщин, и большинство из них отмечали снижение исходно существовавших клинических проявлений менструального цикла, а также значительное улуч-; шение качества жизни (Sulak P. et al., 1996; Sulak P. et al., 1997).
Влияние на эндометрий
В большом количестве исследований было показано, что правильное применение комбинированных пероральных контрацептивов снижает частоту развития гиперплазии и рака эндометрия на 50—60% и что защитное влияние коррелирует с продолжительностью лечения (Stanford J.L. et al., 1993). Непрерывное лечение пероральными контрацептивами, вызывающее постоянное и значительное подавление выработки эстрогенов яичниками, усиливает подавляющее действие прогеста-генного компонента на эндометрий. При непрерывной терапии этинилэстрадиолом по 20 мкг и левоноргестрелом по 100 мкг, проводимой в течение 336 дней, при гистологическом исследовании биоптатов эндометрия 8 женщин у 7 из них выявили отсутствие пролиферативной активности или атрофию эндометрия (Miller L., Hughes J.P., 2003).
Влияние на фертильность
Хотя значительное подавление активности яичников, вызываемое пероральными контрацептивами, может во многих слу-|

|
чаях приводить к аменорее, гипоэстрогения не развивается, поскольку снижение уровня эстрадиола компенсируется наличием экзогенного эстрадиола. Существующие к настоящему моменту данные позволяют утверждать, что длительное применение пе-роральных контрацептивов по его завершении не оказывает неблагоприятного влияния на фертильность (Farrow A. et al, 2002).
Риск, связанный с длительным применением препарата
Несмотря на то что врачи уже много лет эмпирически применяют циклы продленной терапии пероральными контрацептивами для отсрочки менструации, данные по отдаленному риску этой схемы лечения отсутствуют. Риск развития рака или сердечно-сосудистых заболеваний у молодых женщин можно оценить только после проведения курсов лечения у большого количества пацинток в течение достаточно длительного периода времени. Однако в исследовании «Million Women Study» различия между схемами с последовательным и непрерывным назначением эстрогенов и прогестерона в отношении риска развития рака молочной железы выявлено не было (Million Women Study Collaborators, 2003). С другой стороны, защитное действие пероральных контрацептивов в отношении доброкачественных заболеваний молочной железы коррелирует с продолжительностью лечения и активностью прогестагена (Bunion L.A. et al., 1981). Остается также нерешенным вопрос о вероятности развития тромбоэмболических заболеваний, которая при приеме пероральных контрацептивов увеличивается 3—5 раз (Bloemenkamp K.W.M. et al., 2000). Этот риск оказывается наиболее высоким в течение первых шести циклов терапии, что обусловлено влиянием предрасположенности к этому заболеванию, а продолжительность лечения играет менее значимую роль (Bloemenkamp K.W.M. et al., 1999). Учитывая, что абсолютное количество женщин, страдающих венозной тром-боэмболической болезнью в молодом возрасте, очень невелико (по данным Rosendaal E, 1997 — 1—2 женщины на 10 000 женщин в год), для выявления различий в повышении риска между традиционными и продленными схемами назначения пероральных контрацептивов потребуется значительное время.
Известно, что метаболические влияния пероральных контрацептивов в значительной мере зависят от состава препарата и что различные показатели формулы крови могут при этом как повышаться, так и снижаться. При традиционной схеме лечения эти изменения оказываются в значительной степени обратимыми в течение интервала отмены гормонов, продолжающегося в течение 7 дней (Kuhl H. et al., 1988; Jung-Hoff-

|
mann C. et al., 1998). В перспективе необходимо будет оценить, достигается ли стабильный уровень этих показателей при непрерывной терапии или при схемах с продленным циклом и через какой период времени это происходит.
Основные побочные эффекты, обусловленные пролонгированным режимом приема пероральных контрацептивов
В некоторых исследованиях схем с продленным циклом выявлена высокая частота отказа от лечения в связи с наличием не-регулярных маточных кровотечений и «мажущих» кровянистых выделений (Parazzini F. et al., 1994); поэтому необходимо оценить влияние на эти симптомы различных составов пероральных гормональных контрацептивов. В то же время в некоторых исследованиях показано, что многие женщины согласны на возникновение этих побочных реакций при условии исчезновения проблем, связанных с менструацией и/или эндометриозом, а также уменьшения количества менструальных кровотечений в год. (Vercellini P. et al, 1999; Back D J., Orme M.L.E., 1990).
Данные клинических испытаний по сопоставлению побочных эффектов традиционно применяемых схем приема пероральных контрацептивов и пролонгированного режима, в которых использовали одни и те же препараты, не выявили различий по частоте и характеру развивающихся побочных эффектов, например болезненности в молочных железах, тошноты, тревожности, изменения массы тела.
Таким образом, в последние десятилетия наблюдаются несколько основных тенденций в развитии контрацепции: совершенствование химического состава комбинированных контрацептивов, направленное на создание новых прогестагенных компонентов; разработка и внедрение новых путей поступления компонентов препарата в организм женщины (таких как внутриматочная рилизинг-система, влагалищное контрацептивное кольцо и трансдермальная рилизинг-система), а также модернизация схем применения уже существующих комбинированных пероральных контрацептивов. Применение схем с продленным режимом приема пероральных контрацептивов значительно подавляет функцию яичников, что позволяет увеличить эффективность контрацепции, снижая вероятность наступления нежелательной беременности при случайном пропуске таблеток. Кроме того, схемы пролонгированного применения могут явиться терапией выбора при одновременном назначении с препаратами, влияющими на эффективность пероральных контрацептивов. Частота и обильность менструаций при данном способе применения КОК значительно снижают-

|
ся, появляется возможность предотвратить развитие клинических симптомов, связанных как с самим менструальным циклом, так и с периодами отмены препаратов.
Изменения, произошедшие за последние десятилетия
XX века в репродуктивном анамнезе, заболеваемости и соци
альном статусе женщины, диктуют врачам необходимость вы
являть желания пациенток в отношении частоты менструаль
ных кровотечений, а также наличия кровотечений отмены
и/или мажущих кровянистых выделений. Способность регули
ровать эти процессы является еще одним шагом к автономии
женщин. Некоторые авторы называют медикаментозную аме
норею «менструальной нирваной» (Edelman A., 2002).
Существующие данные свидетельствуют, что большинство женщин предпочитают схемы с продленным циклом, несмотря на увеличивающуюся частоту нерегулярных кровянистых выделений, поскольку снижение частоты менструаций и клинических проявлений предменструального синдрома позволяют повысить качество жизни. «Месячные циклы должны быть выбором женщины, а не бедствием» (Blanchard К., 2003).
Активное изучение и применение схем пролонгированного применения пероральных контрацептивов позволит врачам
XXI века использовать контрацептивные препараты не только
с целью контрацепции или лечения ряда гинекологических за
болеваний, но также уделять большее внимание субъективным
ощущениям женщин в отношении своего здоровья и улучше
нию качества жизни.
Таким образом, на сегодняшний день тенденция к применению лекарственных препаратов не только с лечебной целью, но и с позиций выбора образа жизни вызвана совместным решением пациента и врача. Однако для широкого внедрения в клиническую практику схем пролонгированного применения пероральных контрацептивов требуется дальнейшее проведение исследований относительно влияния схем приема пероральных контрацептивов в пролонгированном режиме на общее состояние пациенток, менструальный цикл и его нарушения (дисмено-рея, гиперполименорея), изменения в системе гемостаза, липид-ного спектра крови, на последующее восстановление фертиль-ности после прекращения использования препарата. Существенную роль во внедрении схем пролонгированного применения пероральных контрацептивов в клиническую практику будет играть изучение отношения самих женщин и медицинских работников к данному вопросу. В то же время необходимо помнить, что пролонгированная контрацепция показана не всем женщинам, а перед ее назначением и в процессе ее применения требуется тщательный контроль и динамическое наблюдение.

|
ПЕРОРАЛЬНЫЕ ГОРМОНАЛЬНЫЕ КОНТРАЦЕПТИВЫ, СОДЕРЖАЩИЕ ТОЛЬКО ПРОГЕСТАГЕН (ЧИСТО ПРОГЕСТИНОВЫЕ ТАБЛЕТКИ, ИЛИ МИНИ-ПИЛИ)
Чисто прогестиновые контрацептивы — один из видов гормональной контрацепции, который был создан в связи с необходимостью исключить эстрогеннный компонент, обусловливающий большинство метаболических нарушений: гипертен-зию и, особенно, тромбоэмболические состояния. К чисто прогестиновым методам контрацепции относятся:
• пероральные контрацептивы, содержащие только прогес-таген (чисто прогестиновые таблетки, или мини-пили);
• инъекционные гестагены (Депо-Провера);
• подкожные имплантаты (Норплант, Импланон);
• внутриматочная гормональная система (Мирена).
Все эти контрацептивы различаются по способу введения препарата в организм женщины.
В этой главе будут представлены сведения только о перо-ральных гестагенных контрацептивах — чисто прогестиновых таблетках (ЧПТ). Современные ЧПТ содержат 0, 03—0, 5 мг (30—500 мкг) прогестина, что составляет 1/10—1/2 (15—30%) его доли, входящей в состав комбинированных оральных контрацептивов. К ним относятся:
• Эксклютон — 500 мкг линестренола;
• Микролют — 30 мкг левоноргестрела;
• Чарозетта — 75 мкг дезогестрела.
Механизм действия прогестагенов
1. Повышение вязкости цервикальной слизи.
Прогестагены уменьшают объем крипт, сгущают церви-
кальную слизь, снижают содержание сиаловой кислоты в слизи, снижают активность сперматозоидов, сужают цервикаль-ный канал, препятствуя тем самым проникновению сперматозоидов и некоторых микроорганизмов в цервикальный канал, матку и трубы. Это объясняет как контрацептивный, так и лечебный эффект прогестагенов при воспалительных заболеваниях органов малого таза.
2. Снижение сократительной активности маточных труб за счет снижения сократительной активности и порога возбудимости мышечной клетки.
3. Специфическое действие на эндометрий.
Прогестагены подавляют митотическую активность эндометрия, вызывая его преждевременную секреторную трансформацию, а при длительном использовании в условиях ано-вуляции — гипотрофию и атрофию эндометрия, что препятствует имплантации оплодотворенной яйцеклетки.

|
Механизм действия на эндометрий обуславливает как контрацептивную эффективность, так и лечебный эффект и зависит от дозы прогестагена, его вида и сродства к рецепторам прогестерона.
4. Ингибирующее влияние на секрецию гонадотропных гормонов гипофиза (особенно лютеинизирующего) и, как следствие, торможение овуляции (зависит от дозы гестагенов в таблетке).
Схема применения
ЧПТ принимаются в постоянном режиме, начиная с 1-го дня менструального цикла ежедневно без перерыва на менструацию. Время приема не играет роли, однако последующий прием препарата следует производить в один и тот же выбранный час, так как период полувыведения препарата составляет 22-24 ч. Контрацептивный эффект в полном объеме проявляется через 48 ч. Поэтому необходимо применять дополнительные меры защиты в этот период. В случае пропуска препарата или приеме таблетки позже чем через 24 ч забытую таблетку следует принять как можно скорее и в дальнейшем придерживаться схемы приема таблеток, в то же время используя другие виды контрацепции первые 48 часов.
Исключение составляет Чарозетта. В состав этих чисто про-гестиновых таблеток входит 75 мкг дезогестрела, что позволяет у 97% женщин подавить овуляцию, а период полувыведения составляет 36 ч, как у КОК.
При переходе с КОК на ЧПТ прием последних должен начинаться на следующий же день после окончания использования КОК. Никаких дополнительных мер предосторожности не требуется.
После аборта прием таблеток необходимо начинать сразу же, желательно в день аборта.
Чисто прогестиновые таблетки, как и любой другой метод контрацепции, имеют показания и противопоказания, преимущества и недостатки.
Гестагенные методы контрацепции, так же как и комбинированные эстроген-гестагенные контрацептивы, имеют противопоказания для использования. Существует мнение, что абсолютные противопоказания для использования чисто прогести-новых и комбинированных гормональных контрацептивов одинаковы. Однако гестагенные контрацептивы не влияют на АД, показатели свертываемости крови, следовательно, не вызывают развития тромбоза, незначительно влияют на обмен липидов и функцию печени. Поэтому медицинские противопоказания к применению контрацептивов, содержащих только

|
гестагены, следует рассматривать отдельно от противопоказаний к применению КОК.
Противопоказания к использованию гестагенсодержащих контрацептивов
1. Подтвержденная и предполагаемая беременность.
Гестагенные контрацептивы не должны использоваться во
время беременности. Современные данные доказывают, что низкая доза прогестина в инъекциях, имплантатах, таблетках и прогестиновых ВМС не способствует значительному увеличению риска врожденных пороков развития, самопроизвольного выкидыша или мертворождений. Однако, несмотря на низкую дозу прогестина, лучше избегать приема этих препаратов на ранних сроках беременности.
2. Заболевания печени с нарушением ее функции.
Не существует доказательств, что гестагенные контрацеп-тивы вызывают заболевания печени и желчевыводящих пy-тей. Однако нарушение печеночных функций может затруднить метаболизм ЧПТ. Поэтому не рекомендуется использовать ЧПТ при активном вирусном гепатите, доброкачественных и злокачественных опухолях печени, тяжелом некомпенсированном циррозе и одновременном приеме препаратов, оказывающих влияние на ее ферментативную функцию (ри-фампицин, фенитоин, карбамазепин, барбитураты, топира-мат и др).
3. Поражения мозговых и коронарных артерий.
Теоретически ЧПТ могут оказывать влияние на липидный
спектр крови, тем самым способствовать возникновению и. прогрессированию атеросклероза, а значит, и возникновению инфарктов миокарда и инсультов. Также не показано их применение при ишемической болезни сердца в анамнезе или в настоящий момент.
Не рекомендуется использование ЧПТ женщинам с тромбофлебитом в настоящий момент.
4. Злокачественные опухоли репродуктивной системы (по
ловых органов, молочной железы и др.).
Не существует доказательств, что низкие дозы прогестина могут вызвать рак молочной железы. Тем не менее, рак молочной железы является гормональнозависимой опухолью. Пациенткам с уплотнениями в молочной железе необходимо предварительное обследование у маммолога или онколога. Для женщин с раком молочной железы в настоящем или прошлом (в течение последних 5 лет) чисто прогестиновые контрацептивы использовать не рекомендуется. Использование данного метода контрацепции у женщин с доброкачественными забо-

|
даваниями молочных желез или с семейным анамнезом рака молочной железы не противопоказано.
5. Кровотечения из половых путей неясной этиологии.
Использование чисто прогестиновых контрацептивов не только не вызывает ухудшения заболеваний, симптомом которых являются кровянистые выделения из половых путей (угроза преждевременного прерывания маточной беременности, эктопическая беременность, цервицит, онкологические заболевания половых органов и др.), а часто предотвращает их развитие. Однако ЧПТ могут вызывать нарушение менструального цикла в виде межменструальных кровянистых выделений и ациклических кровотечений, что может привести к запоздалой диагностике заболеваний, имеющих такую же симптоматику. В связи с вышесказанным, данный метод контрацепции при кровотечениях неясной этиологии использовать не рекомендуется.
К относительным противопоказаниям относятся функциональные кисты яичников, так как при применении гестаген-ных контрацептивов отмечена высокая частота их возникновения.
Это же относится и к внематочной беременности в анамнезе, так как гестагены замедляют транспорт яйцеклетки по трубам и возникновение повторной внематочной беременности не исключается.
Преимущества
1. Отсутствие эстрогензависимых побочных реакций.
2. Лучшая переносимость.
3. Возможность применения во время лактации. ЧПТ могут быть использованы при грудном вскармливании, так как не влияют на количество и качество материнского молока и на продолжительность лактации. Имеются данные, что препараты, содержащие только гестаген, даже увеличивают количество материнского молока и удлиняют период лактации. Данный вид контрацепции может применяться через 6 нед. после родов (ВОЗ, 2004).
4. Меньшее, по сравнению с комбинированными эстроген-гестагенными контрацептивами, системное влияние на организм.
5. Прогестагены оказывают незначительное влияние на углеводный, жировой и белковый обмен, артериальное давление.
6. Выраженный лечебный и защитный эффект при альго-дисменорее, овуляторных болях, воспалительных заболеваниях органов малого таза, анемии, фиброзно-кистозной мастопатии, генитальном эндометриозе.

|
7. Прогестагены могут применяться у женщин с экстраге-нитальной патологией (пороки сердца, сахарный диабет бея сосудистых осложнений, варикозное расширение вен, гипер-тензия, мигрень), а также у курящих женщин старше 35 лет.
8. Возможность немедленной отмены препарата.
Недостатки
1. ЧПТ, за исключением Чарозетты, имеют менее выраженную эффективность по сравнению с КОК.
2. Высокая частота нарушений менструального цикла.
3. Ежегодный контроль за приемом таблеток.
Побочные эффекты
Наиболее частым побочным эффектом гестагенных контрацептивов является нарушение менструального цикла:
· межменструальные кровянистые выделения,
· укорочение менструального цикла,
· олигоменорея,
· менометроррагия.
Возможно возникновение нескольких типов таких нарушений одновременно.
По мере увеличения длительности применения гестагенных контрацептивов частота межменструальных кровянистых вы- делений уменьшается, и через 3—6 мес. они обычно прекращаются.
Случаи тяжелых маточных кровотечений, требующих терапевтического вмешательства, чрезвычайно редки (встречаются приблизительно у 0, 5% женщин). Необходимость проведения эстрогенной терапии или кюретажа полости матки возникает редко. При применении гестагенов может также развиваться аменорея. Женщины, использующие гестагенные методы контрацепции, должны быть готовы к тому, что в первые 6 месяцев применения препарата у них могут наблюдаться нерегулярные кровянистые выделения, а затем, в последующие 6 месяцев и далее, редкие кровотечения или аменорея.
Нарушения менструального цикла в виде мажущего характера межменструальных кровянистых выделений и ациклических кровотечений у женщин, использующих чисто прогестиновые таблетки, наблюдаются в 15—20% случаев. Аменорея наблюдается крайне редко.
Некоторые женщины, принимающие контрацептивы, содержащие только гестаген, не могут привыкнуть к нарушениям менструального цикла, несмотря на разъяснения, даваемые им при консультировании. В связи с этим можно использовать различные подходы для уменьшения кровотечений. При отсутствии противопоказаний к применению эстрогенов назначаются комбинированные пероральные контрацептивы или эстрогены в малой дозе в течение 1—3 нед., что в большинстве слу-

|
чаев временно уменьшает или вообще прекращает кровотечение. Не рекомендуется назначать КОК для того, чтобы вызвать кровотечение в случае аменореи, возникшей в результате использования чисто прогестиновых контрацептивов. Эффективность гестагенной контрацепции повышает правильное консультирование.
Редко могут отмечаться такие побочные эффекты как:
• повышение аппетита;
• изменение массы тела;
• снижение либидо;
• депрессия;
• тошнота;
• рвота;
• головные боли;
• нагрубание молочных желез;
• акне.
Большинство побочных эффектов, включая и появление нерегулярных маточных кровотечений, не представляют никакой угрозы для здоровья женщины, хотя и могут причинять беспокойство.
Чем меньше доза гестагена, тем реже встречаются вышеперечисленные реакции. Однако чем меньше доза гестагена, тем меньше и эффективность данного метода контрацепции.
Контрацептивная эффективность
Гестагены блокируют овуляцию, если они применяются в больших дозах. Противозачаточное действие в таком случае обусловлено прежде всего подавлением овуляции, вследствие чего происходят изменения со стороны эндометрия, церви-кальной слизи, что ведет к снижению фертильности. Микродозы гестагенов также обеспечивают контрацепцию у большинства женщин, но без подавления овуляции, а благодаря способности гестагенов повышать вязкость цервикальной слизи и тормозить секреторные изменения эндометрия. Ановуля-Ция наблюдается только у 25—40% женщин при использовании Микролюта и Эксклютона, а при использовании Чарозетты — У 97%. Этим объясняется невысокий эффект малых доз прогес-тагенов. Контрацептивная эффективность мини-пилей составляет от 0, 14 до 10 беременностей на 100 женщин в течение 1 года.
Причинами низкой эффективности ЧПТ, кроме того, являются нерегулярный их прием, развитие рвоты и диареи в течение 2—4 ч после приема таблетки, одновременный прием других лекарственных средств (антибиотиков, транквилизаторов, снотворных, активированного угля, противосудорожных и

|
пртивотуберкулезных) и переход на различные низкокалорийные и вегетарианские диеты.
Возможное системное влияние на организм
Рецепторы к прогестерону имеются во многих тканях организма женщины, в частности, в головном мозге, костной системе, сосудистой стенке, матке, клетках цервикального канала, мочевого пузыря, тканях молочной железы и др. Именно с этим связано как контрацептивное действие про-гестагенов, так и их возможное системное влияние на организм.
Прогестагены обладают способностью влиять на нейрогор-моны и нейропептиды, содержащиеся в мозге, путем связывания с рецепторами прогестерона в ЦНС.
Нормальное функционирование гипоталамической области и других отделов головного мозга характеризуется определенным соотношением дофамина, серотонина и ацетилхоли-на. Именно в гипоталамической области мозга сосредоточены центральные стероидочувствительные системы (рецепторы), участвующие в механизме обратной связи.
Настроение, сексуальное поведение, питание, болевые ощущения и состояние гипоталамо-гипофизарно-яичниковой системы регулируются Р-эндорфинами, вырабатываемыми гипоталамусом.
Применение прогестерона, ципротерона, норэтистерона и норгестимата увеличивает уровень Р-эндорфинов. Медро-ксипрогестерон и дезогестрел этой способностью не обладают. Андрогены снижают уровень р-эндорфинов (Genazzani A.R. el al., 1992).
Гамма-аминомасляная кислота (ГАМК) играет важную роль в активности дофаминергических систем. В гипоталамической области, в частности в аденогипофизе, изменение концентрации одного медиатора влечет за собой сдвиги в концентрации других медиаторов. ГАМК — естественный медиатор мозговой ткани. Наибольшее ее количество отмечается в сером веществе мозга, в гипоталамической области, наименьшее — в спинном мозге, только следы - в других органах и тканях. Снижение уровня ГАМК в мозговой ткани у животных ведет к появлению феномена манежного бега и судорог. Повышение уровня ГАМК сопровождается атаксией, понижением двигательной активности, повышением судорожного порога.
Прогестерон и его метаболиты связываются с рецепторами ГАМК и оказывают психотропное действие на организм женщины, поэтому их применяют для лечения некоторых форм депрессии, агрессии, мигрени, эмоциональной возбудимос-

|
ти Прогестерон может оказывать гипнотический эффект, который используется для лечения предменструального синдрома и психологического стресса. При значительном увеличении концентрации прогестерона может наблюдаться сонливость.
В последнее время исследователей всего мира интересует вопрос о влиянии стероидов на ткань молочной железы. Мам-марный цикл существенно отличается от эндометриального. Хотя изменения в молочных железах происходят в течение цикла, однако пролиферативная и секреторная фазы не соответствуют эстрогенной и гестагенной активности, как в эндометрии. Наоборот, пик пролиферации тканей молочной железы наблюдается тогда, когда пролиферативный эффект в эндометрии минимален — когда имеется максимальная концентрация эндогенного прогестерона.
Эффект прогестагенов в отношении развития рака молочных желез до сих пор неясен; in vivo прогестагены в физиологических концентрациях одновременно оказывают как инги-бирующий, так и активирующий эффект на пролиферацию клеток молочной железы. Прогестагены снижают концентрацию рецепторов к эстрогенам в тканях молочной железы, активность 17р-оксистероиддегидрогеназы, которая способствует превращению неактивного эстрогена в активный, и концентрацию эстрадиола в тканях молочной железы. Прогестагены вызывают пролиферацию эпителиальных клеток и стимулируют как апоптоз, так и митоз. Во II фазе цикла объем ядер эпителиальных клеток больше, чем в пролиферативной фазе, и усиление митотической активности наблюдается только в секреторной фазе. Индекс апоптоза увеличивается во II фазу цикла и компенсируется увеличением индекса митоза в эту же фазу. В случае отсутствия этого балансирующего механизма молочная железа была бы увеличена в объеме вплоть до менопаузы. Прогестагены оказывают наиболее выраженное пролиферативное действие на молочные железы нерожавших женщин.
Весьма важным является влияние прогестагенов на костную систему женщины. Они стимулируют специфические рецепторы остеобластов, блокируют рецепторы к глюкокортикоидам, снижают ингибирующий эффект глюкокортикоидов на остео-синтез, оказывают антирезорбтивное действие.
Как и все стероиды, прогестагены влияют на метаболические процессы. Однако это влияние минимально. В частности, прогестагены в больших дозах могут оказывать влияние на углеводный обмен, снижая толерантность к глюкозе и повышая Концентрацию инсулина в крови. Имеется зависимость между

|
химической структурой прогестагена и влиянием на обмен глюкозы и инсулина.
Следует отметить, что влияние прогестагенов на углеводный обмен зависит не только от их химической структуры, но и от вида животных, на которых проводится исследование. В опы-тах на обезьянах показано, что применение прогестерона и нe-которых синтетических прогестинов приводит к повышению уровня инсулина в ответ на внутривенное введение глюкозы, причем толерантность к глюкозе не нарушается. По мнению исследователей, прогестерон вызывает образование метаболически неактивных форм инсулина. При введении экзогенного инсулина снижение содержания глюкозы в крови происходит медленнее на фоне приема прогестерона. Это свидетельствует об уменьшении скорости утилизации глюкозы на периферии. Мини-дозы прогестагенов не оказывают влияния на метаболизм углеводов у здоровых женщин.
Как и любые активные соединения, прогестагены могут оказывать влияние на липидный спектр крови. Прогестагены подавляют синтез триглицеридов в гепатоцитах и клетках тонн кого кишечника, повышая активность липопротеинлипазы, ускоряют расщепление ЛПВП, тем самым снижая их содержание в плазме крови, и способствуют повышению ЛПНП. В больших дозах прогестагены могут привести к повышению коэффициента атерогенности (КА) — отношения суммы ЛПНП и ЛПОНП к ЛПВП. Повышение КА во время использования гормональной контрацепции является прогностически неблагоприятным, так как предрасполагает к повышению относительного риска развития сердечно-сосудистых осложнений. Выраженность влияния гестагенов на концентрацию ЛПВП обусловлена степенью андрогенной активности стероидов (см. раздел «Сравнительная характеристика прогестагенов, входящих в состав современных КОК»).
Прогестагены не вызывают существенных изменений в свертывающей системе крови и не ведут к увеличению риска возникновения тромбоэмболических осложнений у здоровых женщин. Если параметры гемостаза уже нарушены до начала приема гормональной контрацепции и имеются другие факторы риска, то риск возникновения тромбоэмболических заболеваний может быть повышен.
Присутствие рецепторов к эстрогенам и прогестагенам в эндотелиальной и гладкомышечной стенке сосудов свидетельствует о вовлечении половых гормонов в контроль за метаболизмом и вазоактивной функцией сосудистой стенки вен и артерий. Показано, что половые гормоны влияют на активность нейротрансмиттеров и вазоактивных пептидов в сосудистой

|
стенке, способствуя синтезу и высвобождению факторов вазо-дилатации и вазоконстрикции из эндотелия, и оказывают прямое влияние на расслабление гладко мышечной клетки. На артерии прогестагены в больших дозах могут оказать сосудосуживающее действие. Сосудосуживающий эффект прогестаге-нов проявляется только в месте нарушения целостности стенки сосуда и повреждения эпителия, что и может привести к гиперагрегации тромбоцитов, гиперкоагуляции и развитию артериального тромбоза. Поэтому женщины, имеющие в анамнезе ишемическую болезнь сердца, нарушение мозгового кровообращения, атеросклероз, должны наблюдаться более тщательно. Влияния прогестагенов на вены не отмечено. Поэтому варикозное расширение вен не является противопоказанием для использования прогестагенов. Мини-дозы прогестагенов не оказывают влияния на сосудистую стенку.
Восстановление фертильности
После окончания применения ЧПТ сразу или в течение 3 мес. происходит нормализация менструального цикла и восстановление регенеративной функции.
Каких-либо отклонений в течении беременности и родов не наблюдается, тератогенного эффекта не установлено.
Таким образом, ЧПТ по сравнению с эстрогенсодержащи-ми контрацептивами оказывают меньшее системное влияние на организм женщины, не вызывают эстрогензависимых эффектов, могут использоваться во время лактации и у женщин с экстрагенитальной патологией и при непереносимости эст-рогенсодержащих препаратов. Они обладают выраженным лечебным и протективным эффектом при многих эстрогензависимых заболеваниях. Побочные реакции, возникающие при их использовании, как правило, не требуют какой-либо терапии. Однако эффективность ЧПТ, за исключением Чаро-зетты, уступает эффективности КОК, часто возникающие межменструальные кровянистые выделения снижают их приемлемость. Безопасность применения ЧПТ, как и любых других гормональных контрацептивов, зависит от тщательного учета противопоказаний, знания основ клинической фармакологии, прогнозирования и учета возможных осложнений и побочных реакций, индивидуального подхода, а также от возраста, состояния здоровья, особенностей интимной жизни, переносимости препарата, отношения половых партнеров к их назначению.

|
ГОРМОНАЛЬНЫЕ РИЛИЗИНГ-СИСТЕМЫ
Инъекционная контрацепция
Возможность применения контрацептивов длительного действия продолжает привлекать внимание ученых всего мира. Наиболее изученным, распространенным и хорошо зарекомендовавшим себя инъекционным средством является депо мед-] роксипрогестерона ацетата (ДМПА, препарат Депо-Провера).
Описание метода
Депо-Провера представляет собой водную суспензию с активным ингредиентом — медроксипрогестерона ацетатом (17-гидроксипрогестерон с метиловой группой в положении 6, рис. 2.16) в дозе 150 мг. Прогестагенная активность ДМПА превышает активность 17а-гидроксипрогестерона в 6—10 раз ДМПА лишен эстрогенной и андрогенной активности, свойственной некоторым стероидам, используемым с целью предупреждения беременности.
Абсолютные противопоказания (согласно медицинским «Критериям приемлемости использования методов контрацепции», ВОЗ, 2004):
• тромбоз глубоких вен, тромбоэмболии, в том числе в анамнезе;
• длительная иммобилизация после хирургических операций;
• тромбогенетические мутации (фактор Лейдена, протром-биновые мутации и т.д);
• инсульт, ИБС (в том числе в анамнезе);
• заболевания клапанов сердца (осложненных легочной ги-пертензией, мерцанием предсердий и т.д.);
• множественные факторы риска развития сердечно-сосудистых заболеваний;
• гипертония (АД сист. > 160 мм рт.ст. или АД диаст. > 100 мм рт.ст.);
• вирусный гепатит;
• злокачественные опухоли печени;
• беременность;
• кровотечения из половых путей неясного генеза;
• рак молочных желез (имеющийся в настоящее время).
Механизм контрацептивного действия
Контрацептивное действие ДМПА обусловлено различными механизмами, важнейшими из которых являются подавление овуляции и изменение эндометрия, при котором имплантация яйцеклетки невозможна. Контрацептивный эффект осуществля-

|
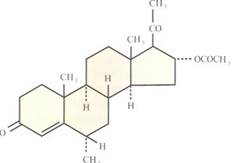
Рис. 2.16. Химическая структура медроксипрогестерона ацетата.
ется на различных уровнях системы гипоталамус—гипофиз—яичники—матка (более подробно о контрацептивном эффекте про-гестагенов см. в соответствующих разделах Руководства).
Преимущества:
• длительная пролонгированная контрацепция;
• стойкий защитный эффект в отношении рака эндометрия;
• отсутствие эстрогензависимых побочных эффектов;
• отсутствие необходимости ежедневного самоконтроля за использованием;
• уменьшение объема менструальной кровопотери;
• повышение уровня гемоглобина;
• снижение риска воспалительных заболеваний;
• снижение частоты кандидозного вульвовагинита;
• отсутствие выраженных изменений со стороны факторов свертывания крови и липидного обмена.
Недостатки
1. Нарушения менструального цикла.
Возникают у большинства женщин на фоне приема препарата и чаще характеризуются ациклическими необильными кровянистыми выделениями продолжительностью 15 дней и более, которые наблюдаются в течение первых месяцев использования препарата. Согласно данным большинства исследователей, при обильных кровянистых выделениях эффективным лечением является повторная инъекция ДМПА, произведенная на их фоне. Третья и последующие инъекции должны

|
производиться в обычные сроки, т.е. с интервалом в 90 дней (Прилепская В.Н., Тагиева Т.Т., 1996; Gertig D. et al., 2004).
С увеличением длительности применения ДМПА частота и продолжительность кровянистых выделений сокращаются, может возникнуть олигоменорея, затем аменорея, что связано с изменениями в эндометрии, прекращением в нем циклических процессов в результате продолжающейся контрацепции. При аменорее рекомендуется исключить беременность с помощью известных методик. Лечения аменореи не требуется, так как после отмены контрацепции цикл восстанавливается са| мостоятельно (Bescrovniy S., Kira E., 2003; Gertig D., 2004).
2. Отсроченное восстановление фертильности.
3 Резорбция костной ткани при длительном применении.
4. Невозможность быстрой отмены данного метода контрацепции.
Возможные побочные эффекты и осложнения
Иногда могут возникнуть такие побочные реакции, как головная боль, снижение либидо, отеки, прибавка в весе. Как правило, побочные реакции не носят выраженного характера и ис-J чезают самостоятельно в первые месяцы контрацепции.
Учитывая, что ДМПА — гестагенный контрацептив, его применение может сопровождаться появлением кровянистых выделений (различной интенсивности), возникающих, как правило, на протяжении первых месяцев применения и имеющих тенденцию к уменьшению при дальнейшем использовании препарата. По данным исследования, проведенного в ГУ НЦ АГиП РАМН, на фоне применения ДМПА у 96, 6% женщин наблюдались нарушение менструального цикла в виде ациклических кровянистых выделений (различной интенсивности и длительности) и аменорея. Продолжительность кровянистых выделении не превышала 8 дней в месяц. У большинства пациенток по| истечении первых 3 месяцев контрацепции частота, продолжительность и интенсивность кровянистых выделений уменьшались с последующим развитием аменореи. Так, к 6-му месяцу контрацепции аменорея наблюдалась у 20% женщин, через 12 мес. — у каждой третьей (Прилепская В.Н., Тагиева ТТ., 1996).
При необильных кровянистых выделениях не требуется назначения какой-либо терапии, так как они имеют тенденцию к уменьшению при дальнейшем применении препарата.
Обильное кровотечение на фоне приема ДМПА возникает крайне редко, менее чем у 1 из 1000 женщин.
В случае обильного и/или длительного кровотечения прежде всего необходимо исключить нераспознанную ранее органическую патологию репродуктивной системы. Обязательным

|
является определение уровня гемоглобина. При обнаружении железодефицитной анемии следует рекомендовать соответствующие препараты (Lamarque J.M., 2003).
При более обильных и длительных кровянистых выделениях, что встречается крайне редко, рекомендуется применение эстрогенов (Микрофолин) в суточной дозе, эквивалентной 0, 05—0, 1 мг этинилэстрадиола в течение 7-15 дней на протяжении 1—2 циклов. Однако до сих пор не проведены работы по изучению эффективности эстрогенной терапии при лечении менструальных нарушений, связанных с применением инъекционных контрацептивов.
У некоторых женщин, применяющих ДМПА, отмечается небольшая прибавка в весе. В большинстве исследований сообщается об увеличении массы тела от 0, 5 до 2 кг к концу первого года применения (Lamarque J., 2003; Truael J., 2004). Согласно исследованию ВОЗ (1991), среднее увеличение массы тела у 607 женщин, применявших ДМПА, составило 1, 5 г (Shirley S., 2001; Bescrovniy S. et al, 2003).
При увеличении массы тела рекомендуется в первые 1—3 месяца соблюдать субкалорийную диету с ограничением жидкости, жиров и углеводов, особенно это относится к женщинам, склонным к ожирению.
При появлении отеков рекомендуется ограничивать количество жидкости.
Поданным Т.Т. Тагиевой (1996), у 48% женщин применение ДМПА сопровождалось быстро проходящими побочными реакциями в виде повышения массы тела, тошноты, незначительных отеков.
Возникновение и исчезновение побочных реакций в первые 3 месяца контрацепции подтверждают концепцию о существовании адаптационного периода, по истечении которого приемлемость гормонального средства повышается.
Результаты проведенных исследований показали, что осложнения и побочные реакции, как правило, связаны с бесконтрольным и длительным применением препарата без учета особенностей женского организма и противопоказаний к применению, что наблюдается в тех случаях, когда женщина принимает препарат без должного врачебного наблюдения или он назначается врачом, недостаточно знакомым с вопросами контрацепции, фармакологическими особенностями препарата, показаниями и противопоказаниями к их назначению.
Схема применения
ДМПА в качестве контрацептивного средства вводят 1 раз в 90 дней в дозе 150 мг внутримышечно. Первую инъекцию не-

|
обходимо произвести в течение первых 7 дней менструального цикла. Соблюдение этого правила чрезвычайно важно, поскольку при этом исключается введение гормонального контрацептива на раннем сроке еще не диагностированной беременности, а также для получения максимального контрацептивного эффекта в течение первого месяца. Последующие инъекции ДМПА проводят с 3-месячными интервалами.
При введении препарата во избежание неправильной дозировки микрокристаллического соединения необходимо тща-тельно встряхнуть флакон перед наполнением шприца суспензией. Раствор вводят глубоко внутримышечно в ягодичную или дельтовидную мышцу. Первоначальный уровень ДМПА в плазме крови высок, а затем постепенно снижается. Однако высокий контрацептивный эффект одной инъекции сохраняется в течение 3 мес. и дольше.
Процедура введения проста, не связана с половым актом и в отличие от большинства пероральных контрацептивов не требует ежедневного самоконтроля.
Наблюдение за пациентками осуществляется в соответствии с рекомендациями ВОЗ (см. гл. 6).
Эффективность
Одна внутримышечная инъекция препарата обеспечивает надежный контрацептивный эффект на 3 мес. (99, 7%).
Высокая контрацептивная эффективность ДМПА подтверждена более чем в 90 странах мира, включая Великобританию, Германию, Бельгию, Францию, США, и около 3, 5 млн женщин всего мира пользуются данным видом предохранения от не-планируемой беременности.
В результате многоцентрового исследования по применению ДМПА в дозе 150 мг с интервалом в 90 дней у 3856 женщин показано, что частота наступления беременности составила 0, 25 на 100 женщин за 1 год (Selim A.G., 2002).
Как показали исследования, предупреждение беременности с помощью внутримышечного введения ДМПА в дозе 150 мг каждые 3 месяца по эффективности не уступает другим методам контрацепции и даже превосходит многие из них. Так, число беременностей в течение 1 года при применении ДМПА составляет 0, 3-1%, пероральных контрацептивов -1 -7%, баьерных методов - до 22% и больше (Yasasever V. et al., 2003).
Таким образом, ДМПА является надежным контрацептивным препаратом, по эффективности сопоставимым с хирургической стерилизацией.

|
Влияние на метаболические процессы
Установлено, что препарат не оказывает отрицательного влияния на состояние желудочно-кишечного тракта и функцию печени, тем самым предотвращая возможность возникновения метаболических изменений. Он также не вызывает высаженных изменений со стороны факторов свертывания крови и липидного обмена, которые могут возникнуть при приеме некоторых пероральных контрацептивов, что определяет его преимущества перед ними в отношении риска возникновения сердечно-сосудистых нарушений.
Многие исследователи, анализируя данные эпидемиологических исследований, не обнаружили связи между повышением риска ИБС и применением ДМПА. Установлено, что ДМПА не повышает частоту тромбозов, поскольку изменения свертывающей системы происходят в основном под влиянием эстрогенного компонента гормональных контрацептивов (Selim A., 2001).
Большинство исследователей считает, что ДМПА не влияет на ферментативную и экскреторную функции печени, не оказывает влияния на показатели активности трансаминаз, щелочной фосфатазы и уровня билирубина в крови. По данным литературы, даже длительное применение ДМПА не оказывает существенного влияния на уровни альбумина и глобулинов плазмы крови. Также не выявлено существенных изменений в плазменных концентрациях таких микроэлементов, как натрий, калий, кальций, магний, цинк, фосфор и медь (Sotanie-mi E.A., 2003; Parkin D.M., 2004).
Восстановление фертильности после отмены ДМПА
После прекращения применения ДМПА у большинства женщин отмечается отсроченное восстановление фертильности. Средняя длительность периода от последней инъекции до восстановления овуляторных циклов составляет 5, 5 мес. У части женщин этот период составляет 1—2 года, при этом фер-тильность быстрее восстанавливается у более молодых женщин. Наличие беременностей в анамнезе и общая продолжительность применения ДМПА не влияют на скорость восстановления фертильности.
Имеются данные о том, что через 1 год после отмены ДМПА число беременностей составило от 5 до 10%. В последующем, к 15-му месяцу отмены препарата, частота наступления беременности возрастает до 75%, а через 2 года — до 95% (Ferguson D., 2003).
По данным другого крупномасштабного исследования, в течение первых 12 месяцев после прекращения применения

|
ДМПА запланированная беременность наступила у 70% жен-щин(Тгиае1., 2004).
Таким образом, клинические исследования, проведенные в нескольких странах, показывают, что задержка в восстановлении фертильности после применения ДМПА не ведет к последующему бесплодию и фертильность восстанавливается, но, как правило, она отсрочена по времени.
Неконтрацептивные лечебные эффекты
Использование ДМПА снижает риск развития воспалительных заболеваний органов малого таза и частоты кандидоз-ного вульвовагинита.
В связи с тем что применение ДМПА способствует уменьшению объема менструальной кровопотери, у женщин, применяющих данный препарат, повышаются уровень гемоглобина и продолжительность жизни эритроцитов.
С нашей точки зрения, целесообразно назначать ДМПА в тех случаях, когда препарат будет оказывать не только контрацептивное, но и лечебное действие. Речь идет о таких заболеваниях, как гиперпластические процессы эндометрия, внутренний эндометриоз, миома матки небольших размеров, в связи с чем применение ДМПА представляется особенно перспективным у женщин в возрасте старше 35 лет (Кулаков В.И. и др., 1998; Кулаков В.И., Прилепская В.Н., 2002).
В ГУ НЦ АГиП РАМН на протяжении 3 лет проводилось изучение влияния препарата на нормальную ткань молочных желез (35 женщин) и на гиперпластические процессы в молочных железах (35 пациенток). Состояние молочных желез оценивали на основании жалоб пациенток, осмотра, пальпации через каждые 3, 6, 9, 12 месяцев. Бесконтрастная маммография проводилась на 8—10-й день менструального цикла. Контрольное рентгенологическое исследование — после окончания контрацепции, но не ранее чем через 1—2 года. В результате наблюдения было выявлено, что под влиянием ДМПА регресс диффузных гиперпластических процессов молочных желез наблюдался у большинства женщин через 12 мес. от начала контрацепции. Вместе с тем у трети женщин рентгенологическая картина оставалась такой же, что и до начала контрацепции.
Таким образом, ДМПА является одним из эффективных контрацептивных средств. Кроме того, при ряде заболеваний применение ДМПА может оказывать и лечебный эффект.

|
ИМПЛАНТАЦИОННАЯ КОНТРАЦЕПЦИЯ
В 80-е годы XX века большую популярность приобрела им-плантационная контрацепция. Этот метод продолжает совершенствоваться и по сей день. Наиболее известным из имплан-тационных препаратов является Норплант.
Разработка Норпланта началась в 1965 г. Для клинического применения Норплант впервые был одобрен в 1983 г. В настоящее время Норплант зарегистрирован и разрешен к применению более чем в 60 странах мира.
Описание метода
Система Норплант состоит из шести цилиндрических по-лиметилсилоксановых (силастиковых) капсул, содержащих гестаген — левоноргестрел. Капсулы Норпланта устанавливаются подкожно, на внутренней поверхности левого плеча в форме веера (рис. 2.17) с помощью простого троакара.
Каждая капсула имеет длину 34 мм, диаметр около 2, 5 мм и содержит 36 мг левоноргестрела.
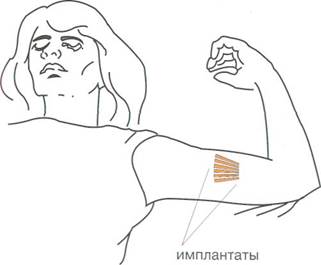
|
| Рис. 2.17. Схема установки капсул Норпланта. |
Гормон диффундирует сквозь силастиковую стенку с постоянной скоростью. Следует отметить, что в первые несколько месяцев после введения Норпланта скорость диффузии левоноргестрела в окружающие ткани и кровь составляет 80 мкг/сут., но затем постепенно снижается и к концу первого года использования достигает 30—34 мкг/сут.

|
Противопоказания (в соответствии с «Критериями приемлемости использования методов контрацепции», ВОЗ, 2004). Абсолютные противопоказания:
• известная или подозреваемая беременность;
• маточные кровотечения неясной этиологии;
• нарушения свертывающей системы крови, в том числе тромбозы, тромбофлебиты;
• частые головные боли;
• острые заболевания печени;
• рак молочной железы, эндометрия, яичников.
Относительные противопоказания:
• прием рифампицина или противосудорожных препаратов;
• стенокардия;
• инсульт;
• циркуляторные нарушения;
• доброкачественные или злокачественные опухоли печени.
Механизм контрацептивного действия
Контрацептивное действие Норпланта определяется несколькими механизмами. Подавление овуляции является одним из основных механизмов контрацептивного действия левоноргестрела. Оно происходит в результате ингибирующего воздействия на гипоталамо-гипофизарно-яичниковую систему и, как следствие этого, подавления секреции гонадотропи-нов ЛГ и ФСГ. Снижение или подавление секреции гонадот-ропинов препятствует созреваниию фолликулов в яичнике, ингибирует овуляцию и предовуляторный пик ЛГ. Воздействие на эндометрий характеризуется торможением пролифера-тивных процессов и развитием атрофических изменений в слизистой оболочке матки, что препятствует имплантации. Цервикальная слизь под воздействием левоноргестрела становится более густой и вязкой, что затрудняет и нарушает пенет-рацию сперматозоидов. Под воздействием левоноргестрела изменяются процессы созревания клеток многослойного плоского эпителия влагалища — увеличивается количество промежуточных клеток. Предполагается также возможность воздействия левоноргестрела на активность ферментов, участвующих в процессе проникновения сперматозоидов в яйцеклетку.
Таким образом, механизм контрацептивного действия ле-воноргестрела в основном идентичен всем рилизинг-сите-мам, основан на блокаде овуляции, нарушении процесса имплантации и изменении транспорта гамет и функции желтого тела.

|
Схема применения
Имплантация проводится в первые 5-7 дней от начала менструации или сразу после произведенного аборта.
Норплант рекомендуется прежде всего тем, кто не желает иметь детей в течение ближайших нескольких лет, и тем, кто вообще не планирует беременность и роды либо закончил свою репродуктивную функцию, но и не хочет прибегнуть к необратимым методам контрацепции, например стерилизации. Помимо этого, Норплант может быть предложен женщинам, которые лишены постоянного источника получения контрацептивов, и пациенткам сразу после произведенного аборта.
Неконтрацептивные лечебные эффекты
Исследования последних лет показали, что гормональные контрацептивы, в том числе и Норплант, не только предотвращают нежелательную беременность, но и способствуют снижению риска опухолевых заболеваний, к которым относятся рак яичников и рак эндометрия. В связи с тем что гормональные контрацептивы способны блокировать овуляцию, они оказывают про-тективное действие в отношении рака яичников, уменьшая потребность в репарации эпителия после повторных овуляций. Предотвращая пролиферативные процессы, повторяющееся отторжение и репарацию эндометрия, гормональные контрацептивы уменьшают частоту возникновения рака эндометрия.
Эффективность
Согласно данным I.Sivin (1980), в течение первого года после имплантации Норпланта беременность наступает лишь у одной женщины из 500, что составляет 0, 2%. Данные Совета по народонаселению, основанные на исследовании 12 333 женщин, свидетельствуют о том, что процентный показатель неудач составляет 1, 2, 1, 6 и 0, 4% беременностей в год соответственно для второго, третьего, четвертого-пятого года использования Норпланта.
Основываясь на результатах исследования 10 710 женщин, использующих Норплант, I.Sivin (1988) отметил, что большинство случаев беременности (индекс Перля — 0, 94) в первый год использования Норпланта наступило еще до имплантации. Поэтому ВОЗ с 1995 г. рекомендует производить имплантацию Норпланта в течение первых 7 дней менструального цикла или сразу после произведенного аборта.
Капсулы Норпланта подлежат обязательному удалению в конце пятого года использования препарата.
Таким образом, Норплант, при соблюдении рекомендаций о сроках введения имплантата и его удаления или замены, находится в ряду эффективных форм обратимой контрацепции.

|
Восстановление фертильности после удаления Норпланта
Восстановление фертильности, вне зависимости от причины удаления имплантированного препарата, происходит дос таточно быстро. Исследования, проведенные J.C.Konje и соавт. (1992), показали, что после удаления Норпланта овуляция восстанавливалась постепенно, но в течение 7 нед. восстановление овуляции произошло у всех женщин, а уже в первом цикле после удаления Норпланта у некоторых женщин наступила беременность.
Возможные побочные эффекты и осложнения
Одним из побочных действий Норпланта являются нарушения менструального цикла. Эти нарушения могут проявляться в виде длительных менструальноподобных кровотечений, кро-вянистых выделений, нерегулярных менструаций, аменореи. Вместе с тем, следует отметить, что нарушения менструального цикла значительно чаще наблюдаются в первый год применения Норпланта, в то время как вероятность возникновения аменореи возрастает по мере увеличения продолжительности использования препарата.
Несмотря на отсутствие данных о неблагоприятном влиянии нерегулярных менструаций и аменореи на здоровье женщин, непредсказуемые эпизоды кровотечений или кровянистых выделений мажущего характера могут причинять женщине неудобства, а длительная аменорея заставляет подозревать незапланированную беременность.
К сожалению, нет эффективного способа диагностики, на основании которого можно было бы заранее предсказать, в ка-ких случаях следует ожидать нарушения менструальной функции. Некоторые авторы высказывают предположение, что чаще кровотечения возникают у тех женщин, которые в прошлом, еще до применения Норпланта, имели различные нарушения менструального цикла.
Кроме того, у части женщин наблюдаются головные боли, тошнота, нервозность, масталгия, акне, увеличение массы те-ла. Крайне редко введение и удаление Норпланта может сопровождаться воспалительным процессом кожи и подкожной клетчатки в месте имплантации. Обычно это связано с нарушениями правил асептики.
Влияние на метаболические процессы
На основании исследований A.Benenson и соавт. (1995), J.Barbosa и соавт. (1995), Z.Haler и соавт. (1996) можно сделать вывод о том, что использование Норпланта не связано с нару-

|
щением функции печени, почек, надпочечников, щитовидной железы. Однако J.Veigas и соавт. (1988) выявили снижение содержания липопротеинов высокой плотности у женщин, применяющих Норплант.
Норплант оказывает лишь незначительное влияние на углеводный обмен. Не имеет клинического значения выявленное очень слабое действие левоноргестрела на толерантность к глюкозе.
Согласно данным литературы, препарат изменяет усвоение кальция костной тканью и снижает его почечную экскрецию.
Применение гестагенов пролонгированного действия, таких как инъекционные контрацептивы и подкожные