
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Слабая кислота сильное основание
|
|
Малодиссоциирующие изменение рН раствора
Частицы

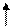 Чем заряд и радиус иона Þ сильнее взаимодействие с Н2О Þ сильнее гидролиз.
Чем заряд и радиус иона Þ сильнее взаимодействие с Н2О Þ сильнее гидролиз.
DНг > 0 - эндотермический процесс.
Количественная характеристика гидролиза:
 |
 |
(для разбавленных растворов а = с)
Гидролиз – обратимый равновесный процесс
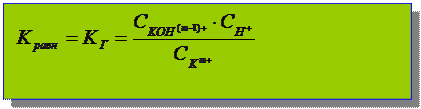
КГ - константа гидролиза
Сi –равновесные концентрации
КГ зависит от: природы реагентов и Т.

 Т.к. D Н Г > 0 Þ с температуры КГ Þ
Т.к. D Н Г > 0 Þ с температуры КГ Þ
Выход продуктов гидролиза растет.
 Применим закон разведения Оствальда:
Применим закон разведения Оствальда:

 | |||||
 | |||||
 | |||||




 |
Соли, образованные сильной кислотой и сильным основанием (Na2SO4) – гидролизу не подвергаются.
 Na2SO4 ® Na+ + SO42-
Na2SO4 ® Na+ + SO42-
NaOH H2SO4
Сильное основание сильная кислота
раствор нейтральный: рН» 7.
 |
 Диссоциация соли: СН3СООNa ® CH3COO- + Na+
Диссоциация соли: СН3СООNa ® CH3COO- + Na+
CH3COOH NaOH
Слабая кислота сильное основание
Гидролиз – по слабому электролиту:
CH3COO- + НОН Û CH3COOH + ОН-
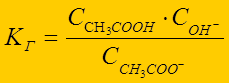 выражение константы гидролиза
выражение константы гидролиза
Гидролиз многозарядных ионов протекает ступенчато (FeCl3):
Fe3+ + НОН Û FeОН2+ + Н+ - 1-я ступень;
FeОН2+ + НОН Û Fe(ОН)2+ + Н+ - 2-я ступень;
Fe(ОН)2+ + НОН Û Fe(ОН)3 + Н+ - 3-я ступень
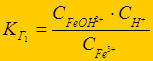
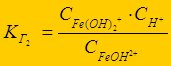

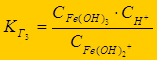 К г1> К г2 > К г3
К г1> К г2 > К г3

AgNO3 ® Ag+ + NO3-
 |  | ||
AgОН HNO3