
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решений
|
|
Пример № 1. Как изменится степень диссоциации уксусной кислоты, если в её раствор добавить ацетат натрия? Почему?
Решение. Если к раствору уксусной кислоты добавить ацетат натрия, практически нацело диссоциирующий по уравнению:
CH3COONa = Na+ + CH3COO-,
то концентрация ацетат-иона в растворе возрастет. Согласно принципу Ле Шателье, увеличение концентрации ионов CH3COO- будет сопровождаться уменьшением концентрации ионов водорода, т.е. смещением равновесия в сторону процесса ассоциации:
CH3COOН  Н+ + CH3COO-.
Н+ + CH3COO-.
Таким образом, одноименные ионы подавляют ионизацию слабых электролитов.
Пример № 2. Рассчитать рН 0, 01 М раствора соляной кислоты
Решение. Соляная кислота - сильная одноосновная кислота.
HCl = H+ + Cl-
[H+] = CHCl = 0, 01; pH = -lg 0, 01 = 2.
Пример № 3. Рассчитать рН 0, 01 М раствора гидроксида натрия.
Решение. Гидроксид натрия - сильное однокислотное основание.
NaOH = Na+ + OH-
[OH-] = CNaOH = 0, 01; pOH = -lg 0, 01 = 2; pH = 14 - pOH = 12.
Пример № 4. Рассчитать рН 0, 01 М раствора уксусной кислоты.
Решение. Уксусная кислота - слабая одноосновная кислота.
CH3COOH  CH3COO- + H+
CH3COO- + H+
Из уравнения реакции следует, что [H+] = [CH3COO-]. Учтем также, что для слабого электролита [CH3COOH]» C. Подставим эти формулы в константу кислотной диссоциации уксусной кислоты и преобразуем полученное выражение:
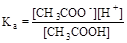 = 1, 75× 10-5;
= 1, 75× 10-5; 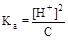 ; [H+] »
; [H+] » 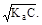
рН = - lg 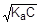 = -1/2(lgKa + lgC) = 1/2(pKa - lgC) = 1/2(4, 75 + 2) = 3, 38.
= -1/2(lgKa + lgC) = 1/2(pKa - lgC) = 1/2(4, 75 + 2) = 3, 38.
Пример № 5. Рассчитать рН 0, 01 М раствора аммиака (гидроксида аммония).
Решение.
NH3·H2O  NH4+ + OH-
NH4+ + OH-
Из уравнения реакции следует, что [NH4+] = [OH-], а [NH3·H2O]» C, поскольку гидроксид аммония слабыйэлектролит. Подставим эти формулы в константу ионизации аммиака как основания и преобразуем полученное выражение:
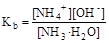 = 1, 8× 10-5;
= 1, 8× 10-5; 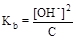 ; [OH-] =
; [OH-] = 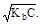
рOН = -lg 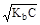 = 1/2(pKb - lgC);
= 1/2(pKb - lgC);
pH = 14 - pOH = 14 + 1/2(lgC - pKb) = 14 + 1/2(-2 - 4, 76) = 10, 62.
Пример № 6. Определить растворимость в воде сульфата свинца и изменение растворимости этого соединения при введении в систему 0, 1 моль/л сульфата калия.
Решение. В соответствии с уравнением: PbSO4(к)  Pb2+(р-р) + SO42-(р-р)
Pb2+(р-р) + SO42-(р-р)
ПР = [Pb2+][SO42 = 1, 6× 10-8.
Из уравнения процесса растворения видно, что [Pb2+] = [SO42-] = s. Отсюда следует:
ПР = s2; s = 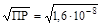 = 1, 26·10-4 (моль/л).
= 1, 26·10-4 (моль/л).
В 0, 01 М растворе сульфата калия [SO42-] = 0, 01; тогда:
s' = [Pb2+] = 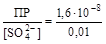 = 1, 6× 10-6 (моль/л).
= 1, 6× 10-6 (моль/л).
Таким образом, после добавления сульфата калия растворимость сульфата свинца уменьшилась в 78, 75 раз
Пример № 7. Рассчитать активности ионов в 0, 01М растворе сульфата калия.
Решение. В соответствии с уравнением диссоциации: K2SO4 = 2K+ + SO 
концентрации ионов калия и сульфат-иона в растворе составляет 0, 02 и 0, 01 моль/л, а ионная сила
μ = 0, 5Σ Сizi2 = 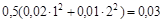 (моль/л).
(моль/л).
Тогда
lg f (K+) = 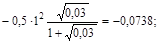 f (K+) = 0, 844;
f (K+) = 0, 844;
а (K+) = f (K+)·С(К+) = 0, 0168 моль/л.
lg f (SO42-) = 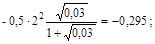 f (SO42-) = 0, 507;
f (SO42-) = 0, 507;
а (SO42-) = f (SO42-)·С(SO42-) = 0, 00507 моль/л.
Пример № 8. Определить степень гидролиза 0, 01 М раствора хлорида аммония.
Решение. Хлорид аммония - соль, образованная слабым основанием и сильной кислотой. Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза:
NH4+ + H2O  NH3·H2O + H+
NH3·H2O + H+

Умножив числитель и знаменатель правой части равенства на концентрацию гидроксид-ионов, константу гидролиза можно преобразовать следующим образом:
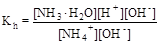
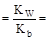
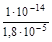 = 5, 56× 10-10.
= 5, 56× 10-10.
Из уравнения гидролиза следует, что [NH3× H2O] = [H+] = Ch, а [NH4+] = C - Ch = C(1-h). Тогда:
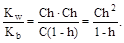
В связи с тем, что h < < 1, полученное выражение можно упростить:
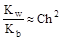 , отсюда h»
, отсюда h» 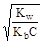 ;
;
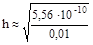 » 2, 36× 10-4 или 0, 0236%.
» 2, 36× 10-4 или 0, 0236%.
Пример № 9. Определить степень гидролиза 0, 01 М раствора ацетата натрия.
Решение. Ацетат натрия - соль, образованная сильным основанием и слабой кислотой. Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
CH3COO- + H2O  CH3COOH + OH-;
CH3COOH + OH-;
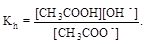
Умножив числитель и знаменатель правой части равенства на концентрацию катиона водорода, его можно преобразовать к следующему виду:
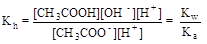 = 1× 10-14/1, 75× 10-5 = 5, 71× 10-10.
= 1× 10-14/1, 75× 10-5 = 5, 71× 10-10.
Из уравнения гидролиза следует, что [CH3COOH] = [OH-] = Ch, а [CH3COO-] = C - Ch = C(1-h). Соответственно,
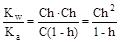 ;
; 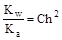 ; отсюда h =
; отсюда h = 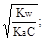
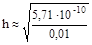 » 2, 39× 10-4 или 0, 0239%.
» 2, 39× 10-4 или 0, 0239%.