
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
C6H5)3C-C(C6H5)3 ® 2(C6H5)3C. при 00С в смеси толуола и анилина: [A, моль/л 0,1000 0,0867 0,0733 0,6000 0,0465 0,0334 t
|
|
при 00С в смеси толуола и анилина:
| [A, моль/л | 0, 1000 | 0, 0867 | 0, 0733 | 0, 6000 | 0, 0465 | 0, 0334 |
| t, мин | 1, 05 | 2, 20 | 3, 65 | 5, 5 | 7, 85 |
Методом Вант-Гоффа определите порядок реакции и рассчитайте значение константы скорости реакции.
6. Перборат натрия разлагается в соответствии с уравнением
NaBO3 + H2O ® NaH2BO3 + 1/2 О2
Процесс разложения является реакцией первого порядка. Константы скорости при 300С и 350С соответственно равны 2, 2× 10-3мин-1 и 4, 1× 10-3мин-1. Вычислить энергию активации реакции, предэкспоненциальный множитель А и время, в течение которого при 400С разложится 90% пербората натрия.
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ ( при С o=1 моль/л) при температуре 450С.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
8. Рассчитайте константу скорости реакции между йодом и водородом при температуре 5000С, если средний диаметр столкновений составляет 2× 10-10 м, а энергия активации 167 кДж/моль. Стерический множитель равен 0, 5.
9. Константы скоростей прямой и обратной реакций
А «B
соответственно равны 2 с-1 и 0, 3 с-1. Исходная концентрация вещества А равна 0, 1 моль/л. Найдите концентрации этих веществ через 0, 4 с.
10. Ионы меди ускоряют реакцию восстановления железа(III) ионами V2+:
Fe3+ + V2+ = Fe2+ + V3+
Для реакции предложен следующий механизм:
 V2+ +Cu2+ V3+ + Cu+ (k1, k-1)
V2+ +Cu2+ V3+ + Cu+ (k1, k-1)
 Cu+ + Fe3+ Cu2+ + Fe2+ (k2)
Cu+ + Fe3+ Cu2+ + Fe2+ (k2)
Используя метод квазистационарных концентраций по Cu+ найдите выражение для скорости образования Fe2+.
11. Кинетика цепной реакции фотохимического хлорирования тетрахлорэтилена в растворе C2Cl4 описывается уравнением
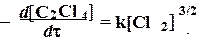
Получите приведенное выше уравнение, если реакция идет по следующей схеме:
k0
 Cl2 + hν 2Cl·
Cl2 + hν 2Cl·
k-1
 Cl· + C2Cl4 C2Cl5·
Cl· + C2Cl4 C2Cl5·
k2
 C2Cl5· + Cl2 C2Cl6+ Cl·
C2Cl5· + Cl2 C2Cl6+ Cl·
k3
 C2Cl5· + C2Cl5· C2Cl6 + C2Cl4
C2Cl5· + C2Cl5· C2Cl6 + C2Cl4
12.