Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Неконкурентное обратимое ингибирование
|
|
Ингибиторы этого типа не родственны по своей структуре субстрату данного фермента; в образовании комплекса с ингибитором участвует в этом случае не активный центр фермента, а какая-нибудь другая часть его молекулы. Это не препятствует соединению субстрата с ферментом, но делает невозможным катализ.
С повышением концентрации ингибитора скорость реакции все более снижается. К моменту насыщения ингибитором она оказывается практически равной нулю. В отличие от конкурентного инги-бирования в этом случае повышение концентрации субстрата на скорость реакции не влияет.
16. Выражение для скорости реакции при конкурентном ингибировании
Е + S ⇔ ES → E + P,
E + I ⇔ EI.
К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется (рис. 2-21).
17. Неконкурентное ингибирование (определение, выражение для скорости реакции)
Некоторые вещества вызывают необратимое ингибирование ферментов. Рассмотрим два примера такого рода.
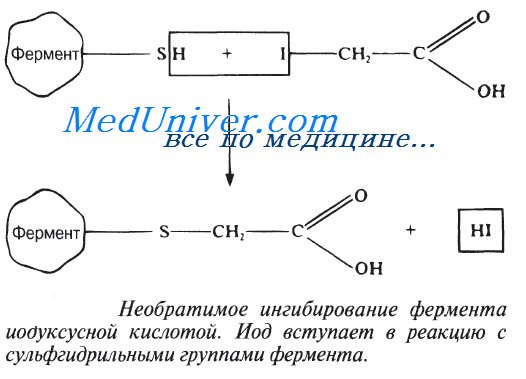
Очень малые концентрации ионов тяжелых металлов, например ионов ртути (Hg2+), серебра (Ag+) и мышьяка (As+), а также определенные иодсодержащие соединения полностью ингибируют некоторые ферменты. Эти вещества необратимо соединяются с сульфгидрильными группами (—SH) в молекуле фермента (рис. 4.13), причем сульфгидрильные группы могут находиться как в активном центре фермента, так и вне его. В любом случае структура фермента нарушается и он теряет способность осуществлять катализ. Может произойти и осаждение ферментного белка.
Другой пример необратимого ингибирования — действие диизопропилфторфосфата (ДФФ), соединения из группы нервно-паралитических отравляющих веществ. ДФФ связывается с остатком аминокислоты серина, находящимся в активном центре фермента ацетилхолинэстеразы. Этот фермент инактивирует ацетилхолин, играющий роль нейромедиатора. Одна из функций ацетилхолина заключается в обеспечении передачи нервного импульса от одного нейрона к другому через синаптическую щель.
Почти сразу после передачи очередного импульса ацетилхолинэстераза инактивирует ацетилхолин, расщепляя его молекулы. Если адетилхолинэстераза ингибирована, то ацетилхолин накапливается, нервные импульсы следуют один за другим, и мышца длительное время не расслабляется. В конце концов наступает паралич, а может наступить и смерть, поскольку затронутыми оказываются также мышцы грудной клетки, в результате чего происходит остановка дыхания. Некоторые из применяемых в настоящее время инсектицидов (например, паратион) оказывают такое же действие на насекомых. Нервную и мышечную системы человека они тоже способны повреждать.