
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Экспериментальная часть. Цель работы: изучение химических особенностей реакции йодирования ацетона, определение средней константы скорости реакции при двух температурах
|
|
Цель работы: изучение химических особенностей реакции йодирования ацетона, определение средней константы скорости реакции при двух температурах, определение энергии активации реакции.
Приборы, посуда, реактивы:
- термостат;
- секундомер;
- мерная колба емкостью 100 мл;
- пипетки емкостью 1, 5, 10 мл;
- бюретка для титрования, емкостью 25 мл;
- растворы: 0, 1 н раствор I в 4% растворе KI; 1 н раствор HCl; 0, 1 н раствор NaHCO3;
Порядок выполнения работы
1. Задают температуру на термостате в диапазоне 20-30°С. В мерную колбу емкостью 100 мл наливают 10 мл 0, 1 н раствора йода в 4% растворе йодистого калия, добавляют в нее 10 мл 1, 0 н раствора HCl, доливают дистиллированную воду, чтобы до метки осталось около 10 мл и помещают в термостат при заданной температуре.
2. Через 10-15 минут, не вынимая колбы из термостата, добавляют в нее пипеткой 1 мл ацетона. Доливают до метки дистиллированную воду и перемешивают. Этот момент считается моментом начала реакции (записывают показания часов или запускают секундомер). Колбу с реакционной смесью закрывают пробкой во избежание улетучивания ацетона.
3. Сразу же после перемешивания отбирают первую пробу реакционной смеси в количестве 10 мл. Пробу вливают в коническую колбу, содержащую 10 мл 0, 1 н NaHCO3 (для прекращения реакции) и титруют 0, 01н. раствором Na2S2O3 в присутствии крахмала. Результаты титрования заносят в таблицу.
4. В последующем пробы отбирают через каждые 20-30 минут при температуре опыта 20-30°С и через 10-15 минут при температуре опыта свыше 30°С. Всего необходимо отобрать 5-6 проб. Результаты титрования заносят в таблицу.
Обработка результатов.
1. Константу скорости реакции рассчитывают по ранее приведенной формуле, учитывая при этом, что
а) 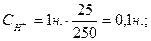
б) 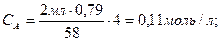
(0, 79 – плотность ацетона, 58 – молекулярный вес ацетона)
в) 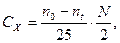
где 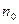 и
и 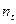 - число мл раствора тиосульфата натрия, пошедшее, соответственно, на титрование первой пробы и последующей пробы, отобранной по истечении t минут от начала реакции;
- число мл раствора тиосульфата натрия, пошедшее, соответственно, на титрование первой пробы и последующей пробы, отобранной по истечении t минут от начала реакции;
N=0, 01 н – нормальность раствора тиосульфата натрия.
Значение 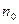 практически определить не удается, так как от момента вливания ацетона до момента взятия первой пробы протекает значительное время. Поэтому
практически определить не удается, так как от момента вливания ацетона до момента взятия первой пробы протекает значительное время. Поэтому 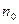 определяют по графику. Для этого на миллиметровой бумаге необходимо построить график в координатах “n – t”и экстраполяцией полученной прямой до t=0 определить
определяют по графику. Для этого на миллиметровой бумаге необходимо построить график в координатах “n – t”и экстраполяцией полученной прямой до t=0 определить 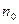 .
.
2. Экспериментальные и расчетные данные сводят в таблицу
| T, °C | t, мин. | 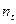 ,
мл. ,
мл.
| CX, г-моль/л | k, л/мин.г-моль |
3. Рассчитывают среднюю константу скорости при двух различных значениях температур (k1 и k2).
4. Рассчитывают энергию активации (Еα ) реакции по средним значениям констант скорости реакции (k1 и k2), определенным при разных температурах (Т1 и Т2, °k).

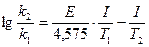 (3)
(3)
или
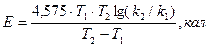 (4)
(4)
5. Определяют (рассчитывают) погрешности прямых и косвенных измерений.
6. Формулируют вывод.
Контрольные вопросы
1. Что называют скоростью химической реакции?
2. Запишите основной закон химической кинетики.
3. Что называют порядком реакции? Как его определяют?
4. Дайте определение и укажите физический смысл константы скорости реакции.
5. От каких факторов зависит скорость и константа скорости реакции.
6. Дайте определение понятию «энергия активации». Укажите способы экспериментального определения энергии активации. Представьте (запишите) уравнение Аррениуса.
7. Почему скорость реакции йодирования ацетона не зависит от концентрации йода?
8. Почему реакцию йодирования ацетона можно назвать автокаталитической?
Литература
1. Белик В.В. Физическая и коллоидная химия. - М.: Академия, 2006.
2. Шершавина А..А. Физическая и коллоидная химия. Методы физико-химического анализа. - М.: Новое знание, 2005.
3. Стромберг А.Г., Семченко Д.П. Физическая химия.-М.: Высш.шк.. 2001.
4.Еремин В.В., Каргов С.И., Успенская И.А. и др. Основы физической химии. Теория и задачи. – М: Издательство «Экзамен». 2005.
5. Гельфман М.И. Практикум по физической химии. – СПб.: Издательство «Лань». 2004.