
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Эмпирическое правило Вант-Гоффа: скорость многих реакций при нагревании на 10К увеличивается в 2-4 раза
|
|
Скорость реакции зависит
1) от природы реагирующих веществ
2) от концентрации или давления реагирующих веществ,
3) от температуры
4) от катализатора
5) от внешних воздействий
Закон действующих масс (закон Гульдберга-Вааге): Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, в степенях некоторых чисел, определяемых экспериментальным путем
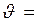 К· Cа A × Cв B
К· Cа A × Cв B
K -константа скорости:
- не зависит от концентрации
- зависит от температуры
- зависит от природы реагирующих веществ
- k – удельная скорость Þ
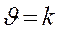 , если СА = С В = 1моль/л
, если СА = С В = 1моль/л - размерность k зависит от порядка реакции,
[моль/л·с]=[ k ]·[моль/л]n
а, в – частные порядки реакции по веществам А и В (определяются экспериментально)
n = (а + в) – общий порядок реакции
В простых реакциях (элементарных актах, протекающих в одну стадию): n = 1, 2 редко 3.
В сложных реакциях (многостадийный процесс): n (0, целочисленные или дробные значения)
Молекулярность - число молекул, участвующих в элементарном химическом акте
Эмпирическое правило Вант-Гоффа: скорость многих реакций при нагревании на 10К увеличивается в 2-4 раза
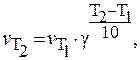
К реакции приводит столкновение лишь тех молекул, энергия которых больше определённой величины Eа
Энергия активации E a (кДж/моль): разность между средней энергией молекул, способных к активным столкновениям, и средней энергией всех молекул
Уравнение Аррениуса:
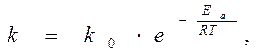
Представим уравнения в логарифмическом виде
ln k = ln k 0 – Еа / RT lg k = lg k 0 – Еа /2, 3 RT
Аналогичное уравнение можно вывести и из скоростей реакции:
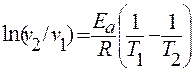
- можно рассчитать k2/k1 или υ 2/υ 1 при двух температурах, если известна Е а
- можно рассчитать Е а, если известно соотношение k2/k1 или υ 2/υ 1 при двух температурах
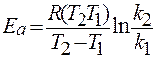
изобара Вант-Гоффа:
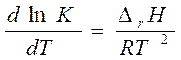
| n | [k] | C = f (t) | t ½ |
| [моль·л-1с-1] | С = С0 - kt | t1/2 = С0 /2k | |
| [с-1] | ln C = lnC0 - kt | 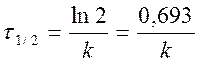
| |
| [л× моль-1× с-1] | 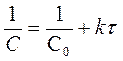
| 
| |
| [л2× моль-2× с-1] | 
| 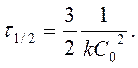
|
период полупревращения τ 1/2: время, за которое прореагировала половина исходного количества вещества
|