
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние температуры на скорость химической реакции. Скорость химической реакции может изменяться не только при изменении концентрации реагирующих веществ
|
|
Скорость химической реакции может изменяться не только при изменении концентрации реагирующих веществ, но и при изменении константы скорости реакции (см. уравнение 2). Последняя зависит от температуры. Количественно влияние температуры на константу скорости реакции можно приблизительно оценить величиной температурного коэффициента g, изменяющегося в пределах от 2 до 4. При повышении температуры на 10 °С константа скорости реакции, а, следовательно, пропорциональная ей величина скорости реакции, при одинаковых начальных концентрациях реагирующих веществ, возрастает в 2…4 раза (правило Вант-Гоффа):
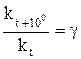 или
или 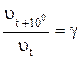 (3)
(3)
где kt – константа скорости реакции при температуре t °С и соответствующая ей скорость реакции ut; 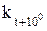 – константа скорости реакции при температуре t + 10 °С и соответствующая ей скорость реакции
– константа скорости реакции при температуре t + 10 °С и соответствующая ей скорость реакции 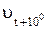 .
.
При повышении температуры на 10n градусов, например, при t2 = t1 + 10n, изменение скорости реакции можно записать следующим образом:
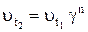 или
или 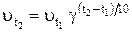 , (4)
, (4)
где 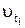 – скорость реакции при температуре t1;
– скорость реакции при температуре t1; 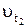 – скорость реакции при температуре t2 = tl + 10°.
– скорость реакции при температуре t2 = tl + 10°.
Правило Вант-Гоффа применимо для реакций, протекающих при сравнительно невысоких температурах. Для более широкого интервала температур используют уравнение Аррениуса:
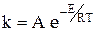 (5)
(5)
где k – константа скорости реакции; А – постоянная, не зависящая от температуры; е – основание натурального логарифма; Е – энергия активации, т.е. минимальная избыточная (по сравнению со средней) энергия, которой должны обладать молекулы для возможности осуществления химического взаимодействия при их столкновении; R – универсальная газовая постоянная, равная 8, 314 Дж/моль× К; Т – термодинамическая температура.
Температурный коэффициент g зависит от энергии активации и температуры. Приближенно эту зависимость можно представить следующим образом:
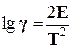 .
.
Отсюда следует, что температурный коэффициент скорости реакций, имеющих одну и ту же величину энергии активации, будет изменяться в зависимости от температуры и принимать значения не только 2–4, но и значения < 2 или > 4. Например, для реакций с энергией активации 60000–105000 Дж/моль правило Вант-Гоффа справедливо только в интервале от 0 до 200 °С, а с энергией активации 160000 Дж/моль – в интервале от 100 до 300 °С.
Влияние температуры на скорость химической реакции объясняет теория активных соударений. По этой теории при столкновении способны реагировать только активные молекулы, т.е. такие, которые имеют избыточный запас энергии по сравнению со средней энергией молекул при данной температуре. Одним из способов активации молекул является нагревание. С повышением температуры число активных молекул возрастает, а, следовательно, возрастает скорость реакции. А именно, с повышением температуры, на 10 °С доля активных молекул возрастает в 2…4 раза. Благодаря этому во столько же раз увеличивается скорость химической реакции (см. правило Вант-Гоффа).