
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние различных факторов на скорость химических реакций
|
|
Раздел физической химии, который изучает течение химического процесса во времени, т.е. скорость и механизм химической реакции, называется химической кинетикой.
Под скоростью химической реакции понимают изменение концентрации реагирующих веществ в единицу времени. На основе обширного экспериментального материала норвежские учёные Гульдберг и Ваге сформулировали основной закон химической кинетики – закон действия масс. Он имеет следующую формулировку: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях их стехиометрических коэффициентов.
Для простой реакции
aA + bB = cC + dD
кинетическое уравнение имеет вид:
v = kc 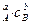 ,
,
где сА, сВ – концентрации веществ А и В в данный момент времени, моль/дм3; k – коэффициент пропорциональности.
Сумма (a + b) равна молекулярности. Коэффициент пропорциональности k называется константой скорости химической реакции. Константа скорости представляет собой скорость реакции, когда концентрации всех исходных реагентов равны 1моль/дм3. Она не зависит от концентрации реагирующих веществ.
Сложная реакция состоит из нескольких стадий, и её скорость определяется скоростью самой медленной стадии – лимитирующей. Для параллельно протекающих реакций скорость определяется по наиболее быстрой из них.Скорость сложной реакции
aA + bB = cC + dD
также зависит от концентраций А и В, но характер этой зависимости может быть определен только опытным путём. Кинетическое уравнение для сложной реакции имеет вид:
v = kc  .
.
Величины l и m называют частными порядками реакции по веществам А и В, а сумма n = l + m – общий порядок реакции.
Порядок реакции – это сумма показателей степеней при концентрациях в кинетическом уравнении реакции.
Порядок сложной реакции может быть величиной как целой, так и дробной (0 ≤ n ≤ 3) и может быть найден только экспериментальным путём. Для простых реакций порядок совпадает с молекулярностью и может быть только целой величиной.
Все выводы относительно зависимости скорости реакции от концентрации реагентов не распространяются на участвующие в реакции твёрдые вещества, т.к. в реакцию вступают только молекулы вещества, находящиеся на поверхности. Поэтому в случае гетерогенных реакций скорость зависит не только от концентрации жидких или газообразных веществ, но и от величины поверхности раздела твёрдых реагентов. Её увеличение ведёт к увеличению скорости реакции. Рассмотрим это на опыте.
Зависимость реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении на каждые десять градусов скорость реакции увеличивается в 2-4 раза.
Математически правило Вант-Гоффа можно выразить следующей математической зависимостью:
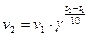 ,
,
где v1 – cкорость реакции при температуре t1; v2 – скорость реакции при температуре t2; γ – температурный коэффициент скорости, равный 2-4 для разных реакций.
Более точно зависимость константы скорости от температуры описывается уравнением Аррениуса:
k = P·Z·e  ,
,
где k – константа скорости реакции; Z – частота столкновений (число столкновений в единице объёма за единицу времени), измеряется в единицах константы скорости; R – газовая постоянная, кДж/моль∙ К; Т – абсолютная температура, К; Еа – энергия активации, кДж/моль.
Под энергией активации понимают минимальный избыток энергии (по сравнению с величиной средней энергии молекул), которым должны обладать молекулы для того, чтобы реакция между ними стала возможной. Такие молекулы называются активными.
Множитель e  называют экспоненциальным; он характеризует долю активных столкновений молекул от их общего числа. Из уравнения Аррениуса вытекает, что доля активных столкновений, а, значит, и константа скорости тем больше, чем меньше энергия активации и чем выше температура. С увеличением температуры повышается кинетическая энергия молекул, а, следовательно, и доля активных молекул.
называют экспоненциальным; он характеризует долю активных столкновений молекул от их общего числа. Из уравнения Аррениуса вытекает, что доля активных столкновений, а, значит, и константа скорости тем больше, чем меньше энергия активации и чем выше температура. С увеличением температуры повышается кинетическая энергия молекул, а, следовательно, и доля активных молекул.
В уравнение Аррениуса введён также поправочный множитель Р (стерический фактор), учитывающий ориентацию сложных молекул в пространстве в момент столкновения по отношению друг к другу. Чем сложнее участвующие в реакции молекулы, тем меньше Р, а значит, и скорость реакции.
Уравнение Аррениуса можно представить также в виде:
 ,
,
где k1, k2 – константы скорости соответственно при температурах Т1 и Т2.
Уравнение Аррениуса используют для вычисления константы скорости реакции при заданной температуре, если известна величина её для другой (близкой) температуры и величина Еа. Интервал температур Т1 и Т2 необходимо брать близким, так как в широком диапазоне Еа заметно изменяется. Можно также по двум константам скоростей, измеренным при двух близких температурах, вычислить энергию активации данной реакции.
Цельработы: изучить влияния концентрации реагентов, температуры и величины поверхности раздела на скорость химических реакций.
Оборудование и реактивы:
1. Пробирки 6 шт.
2. Термометр лабораторный
3. Химический стакан
4. Весы технохимические
5. Секундомер
6. 2н раствор H2SO4
7. 1н раствор Na2S2O3
8. CaCO3
Ход работы: