
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Измерение первичной продукции
|
|
Чистую продукцию удобно выражать в граммах ассимилированного углерода, в сухом весе или в энергетическом эквиваленте сухого веса. Всеми этими показателями пользуются попеременно. Содержание энергии в каком-либо органическом соединении зависит, прежде всего, от содержания в нем углерода и азота. Содержание углерода по весу в большинстве растительных тканей близко к его содержанию в глюкозе, т. е. к 40%. Когда в растениях сахара превращаются в жиры и масла, кислород отщепляется от их молекул, так что относительное содержание углерода возрастает. Например, трипальмитинглицерид (С51Н98С6) содержит 76% углерода по весу. Содержание энергии на 1 г в жирах и маслах более чем вдвое превышает ее содержание в сахарах, а поэтому они очень часто используются растениями и животными для запасания энергии.
Соединение двуокиси углерода и воды в процессе фотосинтеза требует затраты 9, 3 ккал энергии на каждый грамм ассимилированного углерода. Поэтому полное окисление какого-либо углеродсодержащего соединения до двуокиси углерода и воды должно было бы сопровождаться высвобождением ровно 9, 3 ккал на 1 г окисленного углерода. Практически вследствие биохимических перестроек, с которыми связано образование большинства сложных органических соединений, количества энергии оказываются несколько иными. Принято считать, что при окислении 1 г углерода (сахаров, крахмала, целлюлозы) высвобождается 4, 2 ккал энергии, 1 г белка—5, 7 ккал, а 1 г жира—9, 5 ккал.
Общее уравнение продукции допускает несколько возможных методов измерения первичной продукции естественных местообитаний. Поглощение двуокиси углерода и минеральных питательных веществ, выделение кислорода - все эти величины пропорциональны продукции. Для измерения поглощения двуокиси углерода и продукции кислорода и органического вещества существуют надежные методы.
Первичную продукцию наземных экосистем обычно оцениваютпогодовому приросту растительной биомассы (чистая продукция). Для того чтобы определить прирост за год, в конце вегетационного сезона растения срезают, высушивают и взвешивают. Этот метод сбора урожая обычно используют при определении биомассы культурных и дикорастущих растений в умеренных областях, где вся надземная часть у большинства растений ежегодно отмирает. Поскольку рост корней обычно не учитывается (из почв большинства типов корни извлекать трудно), урожай измеряет чистую годовую наземную продуктивность, которая чаще всего и используется в качестве основы для сравнения продуктивности наземных сообществ.
Метод сбора урожая сталкивается с некоторыми трудностями. Часть первичной продукции поедают растительноядные животные. Рост корней, как только что отмечалось, измерить трудно, хотя корневые системы однолетних растений иногда удается отделить от почвы путем длительного отмывания. Однако у многолетников рост корней продолжается из года в год, так что их биомасса представляет собой результат многолетнего роста. Трудности измерения, создаваемые в луговых местообитаниях ростом корней, еще больше увеличиваются в лесах вследствие роста ветвей и стволов деревьев. Сбор листового опада и обрезка свежих побегов дают возможность оценить продукцию лишь частично. Годовой прирост деревянистых частей часто вычисляют, определяя отношение окружности ствола к общей биомассе и измеряя затем годовые приросты живых деревьев. Для оценки общей биомассы срубают ряд деревьев увеличивающегося размера, отделяют стволы от ветвей, а иногда и от корней, после чего сжигают все эти части по отдельности в больших печах и взвешивают золу. Годовой прирост окружности живых деревьев можно затем перевести в увеличение общего веса. Для полной оценки продукции к полученной величине прибавляют прирост листьев, цветков и плодов, т. е. частей, которые возобновляются каждый год.
Специфической чертой продукционного процесса в водоемах служит то, что в образовании первичной продукции их большое значение имеет планктон, биомасса которого, как правило, во много раз меньше годовой продукции. Поэтому ни биомасса планктона в какой-либо момент года, например во время его максимального развития, ни средняя биомасса за год не могут служить мерой первичной продукции
В природе одновременно происходят два противоположных процесса - построение и разрушение органических веществ. Новообразование органических веществ в темноте прекращается, следовательно, прекращается и потребление углекислоты из окружающей среды и выделение в среду эквивалентного количества кислорода. Процессы же дыхания, т. е. потребление кислорода и выделение углекислоты, в темноте идут с той же скоростью, что и на свету. Поэтому, сравнив результаты жизнедеятельности водных сообществ на свету и в темноте, можно рассчитать величину первичной продукции, а в известных случаях и деструкции в водоемах.
О процессах построения и деструкции в принципе можно судить по нескольким различным показателям, например, по скорости потребления кислорода, выделения углекислоты, изменению рН, накоплению продуктов фотосинтеза и пр. В практике исследований в подавляющем большинстве случаев прибегали к измерениям содержания в воде растворенного кислорода. Следует сказать, что скорость потребления кислорода служит наиболее распространенным показателем интенсивности обмена водных организмов и скорости минерализации органических веществ, или скорости деструкции.
Наконец, биомасса водных организмов, пропорциональная количеству органических веществ, может быть выражена эквивалентным ей количеством кислорода, потребного для полного окисления. Биомасса, выраженная в единицах кислорода, оказывается непосредственно сравнимой с результатами измерений интенсивности фотосинтеза (первичной продукции) и дыхания (деструкции). Таким образом, есть основания выделить кислородный метод определения величины первичной продукции в водоемах.
При прослеживании круговорота углерода и изучении некоторых других вопросов можно было бы отдать предпочтение углекислоте в качестве единицы измерения, но для энергетического рассмотрения биотического круговорота углекислота как единица измерения непригодна, так как энергетический эквивалент ее в несравненно большей мере изменяется в зависимости от химического состава вещества. Известно, что для безазотистого дыхательного коэффициента (ДК) энергетические эквиваленты О2 и СО2 составляют следующее число калорий на 1 мл.
Таблица
| ДК | О2 | CO2 |
| 0, 70 0, 80 0, 9 0, 90 | 4, 686 4, 801 4, 924 | 6, 694 6, 001 5, 471 |
| 0, 90 | 4, 924 | 5, 471 |
| 1, 00 | 5, 047 | 5, 047 |
Для кислорода энергетический эквивалент при ДК=0, 70 отклоняется всего на 7% от его значения при ДК=1, 0, в то время как для углекислоты соответствующая разность составляет 33%.
Для определения величин первичной продукции планктона могут быть использованы наблюдения в дневное и ночное время в открытой воде водоемов, т. е. расчеты величин первичной продукции по суточному ходу содержания кислорода и углекислоты, или же наблюдения за результатами жизнедеятельности планктона в воде, заключенной в незатемненные и затемненные сосуды.
Наибольшее распространение получил последний способ, который может быть обозначен как метод склянок.
По истечении известного срока экспозиции, например 24 часов, в незатемненном сосуде должно содержаться больше продуктов фотосинтеза и растворенного в воде кислорода и меньше углекислоты, чем в затемненном. Очевидно, что разности в содержании кислорода или углекислоты строго пропорциональны интенсивности фотосинтеза планктона. Таким образом, об интенсивности фотосинтеза планктона можно судить, пользуясь разными критериями. Соответственно с этим можно различить по меньшей мере три варианта метода склянок. Из них первый технически наиболее простой и наиболее распространенный кислородный вариант.
Техника применения метода склянок проста. В этом существенное достоинство метода, который может быть использован, и в экспедиционных условиях. Склянки должны быть из белого стекла и иметь притертые пробки. Наиболее удобны склянки вместимостью 60— 160 мл. При таком объеме три склянки («контрольная» - для определения начального содержания кислорода, затемненная и незатемненная) могут быть заполнены из одного литрового батометра. С помощью склянок такого размера сделана большая часть наблюдений на разных водоемах, и поэтому такая вместимость их желательна для стандартизации метода.
При всех наблюдениях методом склянок, особенно при стационарных работах, рекомендуется на каждый горизонт устанавливать две светлые и две затемненные склянки, как это и практиковалось почти всеми авторами.
Когда наблюдения ведутся с помощью большого числа склянок, то при определении содержания кислорода удобно титровать не все содержимое склянки, а некоторый объем, отобранный с помощью пипетки после тщательного перемешивания раствора. При этом возможно повысить точность анализа путем повторного титрования. Например, из склянки в 120 мл можно дважды отобрать по 50 мл. При этом способе существенно облегчаются расчеты и отпадает необходимость точной калибровки склянок, но лишь в случае, когда все склянки имеют примерно один и тот же объем.
Склянки с пробами, отобранными на нужной глубине, экспонируются на той же глубине. За исключением специальных наблюдений, срок пребывания склянок в водоеме должен быть равен 24 часам. На протяжении суток начинаются и заканчиваются циклические изменения освещения и других условий.
Расчет первичной продукции по кислородной модификации метода склянок осуществляется следующим образом. Начальное содержание О2 в склянке перед экспонированием составляло V1, после экспозиции в светлой склянке содержание О2 было равно Vс, в темной склянке – Vт. Время экспозиции t = 24 ч.
Первичную продукцию (мг О2/л.ч.) вычисляют по формулам:
валовая продукция: Рвал = (Vс - Vт )/ t
чистая продукция: Рчис = (Vс – V1 )/ t
деструкция: Д = (V1 – Vт ) /t
В данном случае первичная продукция и деструкция выражены в единицах кислорода. Первичная продукция может быть выражена в разных взаимоэквивалентных единицах. При переходе от одних единиц к другим принято исходить из следующих предпосылок: оксикалорийный коэффициент для органического вещества (ОВ) смешанного состава равен 3, 4 кал/мг О2; в органическом веществе содержится 46% углерода; ассимиляционный коэффициент (АК) равен 1, 12, а дыхательный коэффициент (ДК) равен 0, 89. При этих условиях получаем следующие переходные коэффициенты: 3, 2 мгО/мгС, 10, 6 кал/мгС, 0, 69 мгОВ/мгО2, 2, 15 мгОВ/мгС. Если АК = 1, 25 при ДК = 0, 80, то коэффициент перехода от мгО2 к мгС составит 0, 30, от мгС к калориям – 11, 3.
Радиоуглеродную модификацию метода склянок для определения первичной продукции морского планктона впервые применил Стеман-Нильсен во время работ датской морской экспедиции на судне «Галатея» (по Винберг, 1960).
Сущность предложенного Стеман-Нильсеном метода сводится к следующему.
К заключенной в незатемненную склянку пробе добавляется известное количество меченой углекислоты в виде раствора карбоната или бикарбоната. Стеман-Нильсен ввел в практику исследований удобный прием предварительного приготовления ампул, содержащих нужные дозы раствора бикарбоната с меченым углеродом. Им применялись серии ампул, содержащих от 0, 8 до 8 мкСu.
После некоторого срока экспозиции проба профильтровывается через мембранный фильтр. Измерив активность фильтра с осевшим на нем планктоном (г) и зная общую начальную активность внесенного радиоуглерода (R), находят отношение этих величин г/R. Принимается, что количество ассимилированной углекислоты находится в том же соотношении с общим количеством ее во взятом объеме воды (с). Определив последнюю величину гидрохимическим путем, легко рассчитать искомое количество ассимилированной углекислоты (А). Очевидно, А = r c/ R
Однако в такие расчеты приходится вносить некоторые поправки. Прежде всего допущение об одинаковой скорости ассимиляции С12 и С14 заведомо не совсем верно. Известно, что С14 ассимилируется с несколько меньшей скоростью. Это вызывает необходимость поправки на так называемую дискриминацию С14. Стеман-Нильсен считает, что меньшая скорость ассимиляции С14 компенсируется поправкой +5%.
На результаты измерений методом меченого углерода может оказать влияние также темновая фиксация углекислоты, но она обычно не превосходит 1 - 2% от скорости ассимиляции на свету. Однако в загрязненных водах, где много бактерий, она может приобретать исключительно большое значение.
Наиболее слабым местом метода является то, что с его помощью фактически измеряется не все количество ассимилированного радиоактивного углерода. Некоторая часть ассимилированных атомов во время опыта принимает участие в дыхании и вновь уходит во внешнюю среду в составе выделенных при дыхании молекул СО2. Какая доля от ассимилированных атомов С14 будет вновь отдана окружающей клетки среде, зависит от многих условий, в частности, и от продолжительности опытов. В длительных опытах вся выделяемая npи дыхании углекислота идентична ассимилированной; в этих условиях этим методом измеряется не валовая, а чистая продукция, т. е. не истинный, а видимый фотосинтез. Полагают, что при кратковременных опытах в среднем 60% выделяемой при дыхании углекислоты приходится за счет ассимилированной при фотосинтезе и что в условиях оптимального освещения интенсивность дыхания составляет 10% от интенсивности фотосинтеза. Тогда для получения истинного фотосинтеза (валовой продукции) следует внести поправку +6%. Вместе с поправками на дискриминацию С14 и на темновую фиксацию углекислоты (-1%) - это составит (+5 - 1+6) =10%. Последнюю величину (10%) Стеман-Нильсен вводит во все расчеты первичной продукции планктона. Но такая величина поправки годится только для условий, при которых дыхание составляет 10% от фотосинтеза. Когда дыхание составляет 25% от фотосинтеза, поправка равна 20%, при 50% поправка будет 50% и т.д.
Таким образом, в различных условиях поправка должна быть разной, так что любое принятое постоянное значение ее будет в значительной мере произвольным. В связи с этим Джитс предложил отказаться от внесения поправки, ограничиваясь точными указаниями, при каких условиях (сроки экспозиции, освещение и пр.) получены соответствующие данные.
Стеман-Нильсен отмечает, что при низких интенсивностях света поправка особенно велика. Поэтому он считает, что метод С14 не пригоден для измерений интенсивности фотосинтеза при очень малых интенсивностях света.
Наличие хлорофилла в клетках является необходимым условием фотосинтеза. Большое число работ показывает закономерную связь между количеством хлорофилла растительных клеток и их продукцией и биомассой. Хлорофилльный метод измерения первичной продукции фитопланктона является весьма приближенным и его использование рекомендуется только в том случае, если невозможно измерение скляночным методом. Ориентировочный расчет продукции и биомассы фитопланктона по концентрации хлорофилла " а" проводят исходя из того, что хлорофилл " а" составляет 2, 5 % сухой биомассы или 6, 75% содержания органического углерода. Содержание хлорофилла " а" определяют фотометрическими и спектрофотометрическими методами.
X. Одум (Н. Оdum) определял продукцию в сообществе целой реки, сравнивая изменение содержания кислорода в речной воде в дневное и ночное время и внося поправки на обмен кислородом между рекой и атмосферой. Комбинируя метод Одума с методом светлых и темных бутылей и с обычными методами сбора урожая (для тех мест, где растут крупные водоросли), можно довольно точно измерить продукцию в водных сообществах.
Для измерения фотосинтеза в наземных экосистемах удобнее использовать обмен двуокиси углерода, чем обмен кислорода, так как двуокиси углерода в атмосфере содержится меньше. Небольшие изменения содержания двуокиси углерода измерить относительно легко (в атмосфере содержится всего 0, 03% СО2), и утечки из камер для взятия проб не порождают серьезных ошибок. Метод измерения продукции по двуокиси углерода сходен с методом светлых и темных склянок. Часть местообитания или даже отдельное растение заключают в воздухонепроницаемую камеру и сравнивают уменьшение содержания СО2 в течение дня с его повышением (за счет одного только дыхания) ночью. Этот метод позволяет довольно точно измерять общую продукцию.
Использование радиоактивного углерода, в частности изотопа 14С, представляет собой модификацию метода измерения продуктивности, основанную на газообмене. Когда в воздухонепроницаемую камеру добавляют известное количество радиоактивного углерода в форме СО2, растения ассимилируют радиоактивные атомы углерода в такой же пропорции, в какой они содержатся в воздухе камеры. Скорость фиксации углерода вычисляют, разделяя количество радиоактивного углерода, содержащееся в растении, на долю радиоактивной СО2 в камере в начале эксперимента. Таким образом, если растение ассимилирует 10 мг 14С за 1 ч, а доля 14СО2 в камере равна 5%, то можно вычислить, что растение ассимилирует углерод со скоростью 200 мг/ч (10: 0, 05). В процессе дыхания растение в конечном счете снова выделяет часть ассимилированного углерода в воздух в виде СО2, которую оно может ассимилировать вторично. Измеряя поглощение радиоактивного углерода на протяжении 1-3 ч, можно получить надежную оценку общей продуктивности. По прошествии одного-двух дней поглощение и выделение радиоактивного углерода приближается к стационарному уровню и получаемые оценки скорее относятся к чистой, нежели к общей продукции.
Помимо С02 и воды, для синтеза органических соединений растения используют и другие вещества. Исчезновение из водных местообитаний растворенных нитратов и фосфатов может иногда служить относительной мерой чистой продукции, но только при определенных условиях: рост должен происходить быстро и растения должны превращать неорганические питательные вещества в биомассу гораздо быстрее, чем вещества эти становятся им доступными в результате разложения мертвых растений или смешивания с глубинными слоями воды. Когда процессы продукции и разложения уравновешиваются и устанавливается некий стационарный режим, то освобождение неорганических питательных веществ при разложении происходит с такой же скоростью, как их ассимиляция при фотосинтезе, а поэтому концентрация в среде растворенных питательных веществ не изменяется. Кроме того, следует иметь в виду, что накопление питательных веществ в растениях не обязательно связано какой-то постоянной зависимостью со скоростью продукции. Известно, например, что водоросли поглощают больше фосфора при высоком содержании в среде растворенных фосфатов, чем при их недостатке. А иногда растворенные минеральные вещества выделяются растениями в среду. Многие физические и химические процессы, в частности эрозия, апвеллинг и осаждение, также оказывают влияние на содержание питательных веществ в водных системах. Надежные оценки продуктивности по исчезновению из среды неорганических питательных веществ можно получить только в период «цветения» водорослей, наступающий в морях и озерах умеренной и арктической зон вслед за зимним периодом покоя..
Наконец, еще один метод оценки растительной продукции основан на представлении о том, что интенсивность фотосинтеза определяется количеством хлорофилла. Морские водоросли ассимилируют максимум 3, 7 г углерода на 1 г хлорофилла в 1 ч. Общую продуктивность данного участка моря можно оценить, если известна концентрация хлорофилла на разной глубине и уменьшение освещенности с глубиной. Хотя этот хлорофилловый метод менее точен, чем методы, основанные на газообмене, он тем не менее позволяет довольно просто и быстро оценивать продуктивность океанов и озер.
Сравнение нескольких методов измерения продуктивности водных экосистем было проведено на фьордовом озере Огак на Баффиновой Земле (Канада). Первичную продукцию измеряли в течение всего вегетационного сезона по поглощению радиоактивного углерода в светлых бутылях, помещенных в озеро, а кроме того, наблюдали за изменением концентрации хлорофилла, нитратов, фосфатов и растворенного кислорода (рис. 7.2). Суточная продуктивность озера быстро возрастала в начале лета, когда лед исчезал с поверхности и свет начинал проникать в глубину воды. Концентрация хлорофилла возрастала параллельно возрастанию продуктивности, а концентрации нитратов и фосфатов понижались на протяжении всего лета.
Концентрация растворенного кислорода повышалась весной вместе с вспышкой растительной ^продукции, но затем усиление дыхания зоопланктона затруднило выявление какой-либо прямой зависимости между концентрацией кислорода и продукцией. Любопытно, что возрастание продукции, наблюдавшееся в конце лета, не зависело ни от одного из регистрируемых факторов.


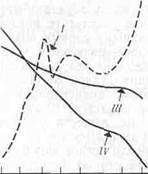

Рис. 7.2. Соотношение между продуктивностью фитопланктона (/) к концентрацией хлорофилла (II), фосфатов (х1, 7) (III), нитратов (IV), кислорода (V) и зоопланктона (VI, произвольные единицы) в озере Огак на Баффиновой Земле.
СВЕТ И ФОТОСИНТЕЗ
Изучая работу фотосинтетического аппарата растения при разных интенсивностях света, физиологи растений установили влияние света на продуктивность.
При сравнительно низких освещенностях, обычно менее 25% освещенности в яркий солнечный день, интенсивность фотосинтеза прямо пропорциональна интенсивности света. Однако при более ярком свете фотосинтетические пигменты насыщаются и скорость фотосинтеза возрастает медленнее или остается на одном уровне. У многих водорослей на очень ярком свету фотосинтез замедляется, поскольку такой свет инактивирует или даже разрушает фотосинтетический аппарат.
Разные виды растений по-разному реагируют на освещенность. Так, у нескольких групп водорослей, образующих морской фитопланктон, фотосинтез достигает максимума при интенсивностях света от 0, 5 до 2 ккал (м2 мин) (рис. 7.3). Вместе с тем, хотя в листьях дуба и кизила световое насыщение достигается при интенсивностях, сходных с теми, при которых наступает насыщение у водорослей, интенсивности выше насыщающих не подавляют фотосинтетическую активность у этих видов. У ладанной сосны световое насыщение достигается только в самые ясные дни.
Солнечный свет, падающий на поверхность листа, состоит из лучей фазной длины волны. Не все области спектра используются в процессе фотосинтеза. Зеленые листья содержат несколько пигментов, в частности хлорофиллы и каротиноиды, которые поглощают свет и используют его энергию.
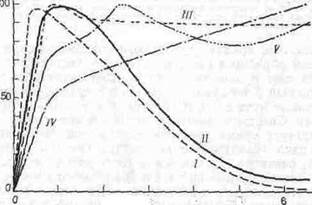
Рис. 7.3. Зависимость между интенсивностьюсвета и фотосинтезом у зеленых водорослей (У), диатомовых водорослей (//), белого дуба (Л/), ладанной сосны (/V) и кизила (V).
Фиолетовый Синий Зеленый Желтый Оранжевый Красный
Длина волны, нм
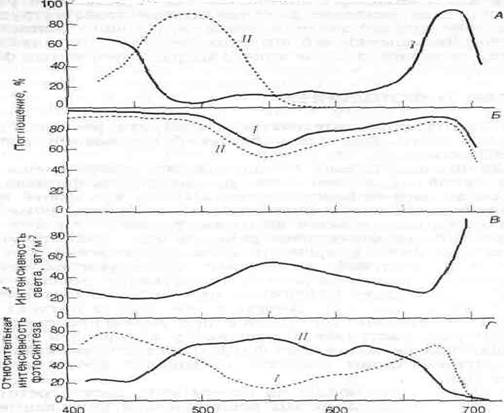
Рис. Поглощение света различной длины волны (спектр поглощения) в пределах видимой части спектра.
А. Спектры поглощения двух светочувствительных пигментов—хлорофилла (Л и каротиноидов (Л). Б. Спектр поглощения целых листьев фасоли (/) и табака (//). В. Спектральное разложение света в тени леса из сахарного клена. Г. Относительная интенсивность фотосинтеза у мелководной аеленой водоросли Шуи (I) и у глубоководной красной водоросли РогрНуга (II) как функция области спектра. Красные водоросли фотосинтетически более активны в средней области спектра. Пигменты красных водорослей поглощают также синий и красный свет, но эти длины волн фотосинтетически относительно неактивны.
Каротиноиды поглощают свет главным образом в синей и зеленой областях спектра (рис., А) и отражают свет с длинами волн, соответствующими желтой и оранжевой областям. Хлорофилл поглощает в красной и фиолетовой областях и отражает лучи зеленой области, которые мы и воспринимаем как цвет листьев. Спектр поглощения листьев в целом (рис. Б) примерно соответствует сумме спектров поглощения фотосинтетических пигментов, однако значительное количество света в оранжевой области поглощают, очевидно, органические соединения, не участвующие в фотосинтезе. Листья разных видов растений имеют разные спектры поглощения. Толстые, сильно пигментированные листья инжира поглощают 85% зеленого света (550 нм) — область спектра, в которой поглощение наименее интенсивно. Листья табака поглощают только 50% зеленого света. Вследствие такого избирательного поглощения света листьями свет, проникающий под полог леса, относительно богат в зеленой и инфракрасной, но беден в красно-оранжевой и голубой областях спектра (рис. В).
Хотя вода кажется бесцветной, она поглощает небольшое количество света в красной области спектра и рассеивает голубой свет. Таким образом, вблизи нижней границы эвфотической зоны в океане преобладает зеленый свет. Фотосинтетические пигменты растений, живущих на суше и на мелководьях, слабо поглощают в зеленой области спектра, однако некоторые глубоководные морские водоросли содержат красные пигменты (эритрины), сильно поглощающие зеленый свет (рис., Г). Эритрины в прямых лучах солнца окрашены в красный цвет, а поэтому эти водоросли называют красными. Способность красных водорослей использовать зеленый свет позволяет им проникать на большую глубину, где не могут жить зеленые водоросли, содержащие такие же пигменты, как наземные растения.
ТЕМПЕРАТУРА И ФОТОСИНТЕЗ
В естественных системах температура обычно тесно коррелирует с интенсивностью света, но в лабораторных условиях, регулируя эти факторы, можно изучить влияние на фотосинтез каждого из них по отдельности. При низких освещенностях, когда лимитирующим фактором является свет, изменение температуры мало влияет на фотосинтез, однако при умеренной освещенности интенсивность фотосинтеза возрастает в 2—5 раз при повышении температуры на каждые 10 °С.
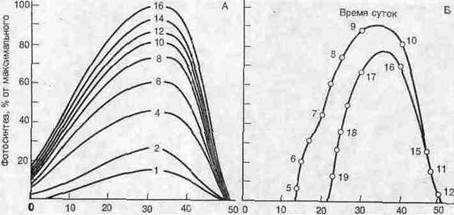
Подобно большинству других физиологических функций, фотосинтез достигает максимального уровня в пределах сравнительно узкого диапазона температур, а при дальнейшем повышении температуры его интенсивность быстро падает. Поскольку листья поглощают свет, их температура к середине дня может повыситься столь значительно, что фотосинтез существенно подавляется; поэтому фотосинтез достигает максимальной интенсивности утром, около 9 часов, затем интенсивность его снижается и.вновь повышается до пиковой около 17 часов (рис.). Как и следовало ожидать, температура, оптимальная для фотосинтеза, варьирует в зависимости от среды и составляет примерно от 16 °С для многих видов умеренного пояса до 38 °С для тропических растений.
Интенсивность света, / ккал/м2.мин
Температура, °С
Рис..
А. Зависимость интенсивности фотосинтеза от температуры листьев и интенсивности падающего света. Б. Изменение интенсивности фотосинтеза в течение дня; к полудню интенсивность резко падает, так как листья слишком сильно нагреваются.
Эффективность фотосинтеза - удобный показатель для выявления скорости образования первичной продукции в растительных формациях в естественных условиях. Она выражается в процентах падающего видимого излучения, которое превращается в чистую первичную продукцию в течение тех сезонов, когда происходит активный фотосинтез. Если вода и питательные вещества имеются в достатке и не ограничивают растительную продукцию, то максимальная эффективность фотосинтеза составляет 1—2% доступной световой энергии.