
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Равновесия
|
|
Соли хромовой кислоты – хроматы окрашены в желтый цвет, а соли дихромовой кислоты – дихроматы – в оранжевый цвет. В растворах этих солей имеет место равновесие:
2СrО 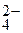 + 2Н+ (р)
+ 2Н+ (р) 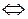 Сг2О
Сг2О 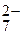 + Н2О (ж), (4.37)
+ Н2О (ж), (4.37)
хромат-ион дихромат-ион
(желтый) (оранжевый)
которое легко смещается при изменении концентрации ионов водорода.
Вычислите Δ Н 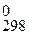 , Δ G
, Δ G 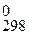 (табл.П.1.7) и К С (4.32)химической реакции и определите, в каком направлении смещено равновесие реакции (4.37) в стандартных условиях. Как велико влияние температуры на состояние равновесия? Проверьте результаты расчетов опытным путем.
(табл.П.1.7) и К С (4.32)химической реакции и определите, в каком направлении смещено равновесие реакции (4.37) в стандартных условиях. Как велико влияние температуры на состояние равновесия? Проверьте результаты расчетов опытным путем.
В пробирку налейте 1 мл 1 М К2Сг2О7и добавьтестолько же разбавленного раствораКОН.Наблюдайте переход окраски. К этому же раствору прибавляйте по каплям раствор 1 М Н2SО4до тех пор, пока окраска раствора не станет прежней.
Объясните изменение окраски исходя из принципа Ле-Шателье. Нагрейте над спиртовкой 1 мл 1 М раствора К2Сг2О7.Заметно ли изменение окраски раствора? Напишите выражение для константы равновесия.
Вариант 3. Влияние температуры на смещение химического