
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Министерство образования Российской Федерации
|
|
ТЕРМОХИМИЯ И КИНЕТИКА
Москва 2003
Министерство образования Российской Федерации
_______________
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИНЖЕНЕРНОЙ ЭКОЛОГИИ
________________________________________________
Кафедра «Общая и физическая химия»
ТЕРМОХИМИЯ И КИНЕТИКА
Методические указания
Под редакцией д-ра хим. наук В.С.Первова
Москва 2003
Допущено редакционно-издательским советом.
Составители: В.В.Горбунов, Е.А.Зеляева, Г.С.Исаева
УДК 554, 4; 544, 33
Термохимия и кинетика: Методические указания
/Cост.: В.В.Горбунов, Е.А.Зеляева, Г.С.Исаева;
М.: МГУИЭ, 2003. - 24.
Методические указания предназначены студентам всех специальностей дневных и вечернего факультетов, изучающим общую химию. Работа содержит теоретические сведения по разделу «Термохимия и кинетика», а также контрольные вопросы, упражнения и задачи, необходимые для самостоятельной подготовки к лабораторным и контрольным работам.
Рецензенты: кафедра физической химии МГПУ;
доц. Т.С.Тамурова, РУДН.
© В.В.Горбунов, Е.А. Зеляева, Г.С.Исаева, 2003
© МГУИЭ, 2003
ТЕРМОХИМИЯ
Тепловой эффект реакции. Экзотермические и эндотермические реакции. Термохимические уравнения реакций. Стандартная энтальпия образования вещества. Закон Гесса и применение его для термохимических расчетов.
Химические реакции протекают с выделением или поглощением энергии, чаще всего в виде теплоты. Реакции, при которых теплота выделяется, называются экзотермическими, поглощается – эндотермическими. Количество теплоты, выделяющееся или поглощающееся при химической реакции, протекающей при постоянной температуре, называется тепловым эффектом реакции. При постоянном давлении тепловой эффект реакции равен изменению энтальпии (Δ Н). Тепловой эффект экзотермической реакции считают отрицательным (Δ Н< 0), а эндотермической – положительным (Δ Н> 0).
Тепловой эффект реакции выражается в единицах энергии – килоджоулях (кДж) или килокалориях (ккал) (1ккал = 4, 1868кДж).
Наука, которая изучает тепловые эффекты химических реакций, называется термохимией, а уравнения химических реакций, в которых указывается тепловой эффект, - термохимическими уравнениями.
Тепловой эффект реакции (Δ Н) зависит от природы реагирующих веществ, от количества этих веществ и их агрегатного состояния, от температуры.
Для сопоставления энергетических эффектов различных реакций и для проведения термохимических расчетов используют стандартные тепловые эффекты (обозначаются  ).
).
Под стандартным понимается тепловой эффект реакции, осуществляемой в условиях, когда все участвующие в реакции вещества находятся в заданных стандартных состояниях (давление 101 кПа).
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (Δ Н°) записывать отдельно, через запятую.
Например, термохимическое уравнение
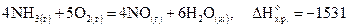 кДж,
кДж,
показывает, что данная химическая реакция сопровождается выделением 1531кДж теплоты, если давление 101кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции.
Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Стандартной теплотой (энтальпией) образования сложного вещества называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимии часто используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
Например, 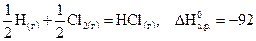 кДж.
кДж.
Тепловой эффект данной химической реакции равняется энтальпии образования HCl(г), т.е. 
В основе термохимических расчетов лежит законГесса. Тепловой эффект (∆ Н) химической реакции (при постоянных Р и Т) не зависит от пути ее протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции.
Следствия из закона Гесса
1. Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
2. Тепловой эффект химической реакции (∆ Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учетом коэффициентов в уравнении реакции.
Примеры решения задач
Пример 1.
При образовании 1, 8 г воды (H2O(ж)) из газообразных водорода и кислорода выделилось 28, 6 кДж тепла. Вычислить энтальпию образования H2O(ж) и написать уравнение реакции, тепловой эффект которой равен 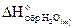 .
.
Решение. 1-й способ.
Так как 1 моль воды равен 18 г, то энтальпию образования
1 моль H2O(ж) можно вычислить
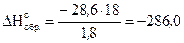 кДж/моль,
кДж/моль,
что соответствует уравнению

 кДж/моль.
кДж/моль.
2-й способ: Из условия: DH=-28, 6 кДж.
По определению: 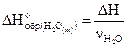 ;
;
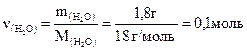
Следовательно,
 кДж/моль.
кДж/моль.
Пример 2.
Вычислить энтальпию образования N2O5(кр), если известен тепловой эффект реакции
N2O5(к)+2KOH(к)=2KNO3(к)+H2O(ж);  кДж,
кДж,
а также энтальпии образования KOH(к), KNO3(к) и H2O(ж),
которые соответственно равны
-425, 0; -493, 2 и –286, 0 (кДж/моль).
Решение
Используя следствие из закона Гесса, запишем

Подставим данные из условия и получим
-380, 6=(2× -493, 2-286)-(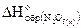 +2× -425)
+2× -425)
Проводим арифметические вычисления:
-380, 6=-422, 4-  .
.
Отсюда
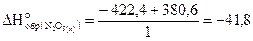 кДж/моль
кДж/моль
Пример 3.
Сколько выделится теплоты при получении 1 кг железа по реакции
Fe2O3(к)+3СО(г)=2Fe(к)+3СО2(г),
если энтальпии образования Fe2O3(к), СО(г) и СО2(г)
соответственно равны (кДж/моль):
-822, 7; -110, 6 и -394, 0.
Решение
1.Вычисляем тепловой эффект реакции (DH), используя следствие из закона Гесса.

Так как энтальпия образования простого вещества принимается равной нулю то,  .
.
Тогда
 кДж
кДж
- Проведем расчет по термохимическому уравнению:
если образуется 2× 56г Fe, то выделяется 27, 2 кДж;
если образуется 1000г Fe, то выделяется х кДж.
Решаем пропорцию и получаем
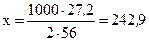 кДж, т.е.
кДж, т.е.
выделится 242, 9 кДж теплоты.
Контрольные вопросы и задачи
1. Что называется тепловым эффектом химической реакции (DH)?
2. Перечислите факторы, влияющие на тепловой эффект химической реакции (DH).
3. Какие реакции называются экзотермическими и эндотермическими? Приведите примеры.
4. Какой знак имеет тепловой эффект (DH) для экзотермических и эндотермических реакций?
5. Дайте определение стандартной энтальпии образования сложного вещества  .
.
6. Дайте формулировку закона Гесса.
7. Сформулируйте следствия из закона Гесса.
8. При взаимодействии 1 моль водорода и 1 моль хлора выделяется 184 кДж. Чему равна энтальпия образования хлористого водорода 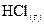 ?
?
9. На разложение 1 моль бромистого водорода на простые вещества требуется затратить 72 кДж теплоты. Чему равна энтальпия образования HBr?
10. При образовании 2 моль газообразного HCl выделяется 184 кДж. Чему равна энтальпия образования 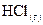 ?
?
11. Чему равен тепловой эффект разложения 1 моль хлористого водорода на простые вещества, если 
= -92 кДж/моль?
12. При образовании 2 моль паров воды выделилось
490, 2 кДж. Чему равна энтальпия образования 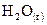 ?
?
13. При полном сгорании 1 моль водорода в кислороде выделилось 245, 1 кДж. Чему равна энтальпия образования 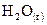 ?
?
14. Определите тепловой эффект (DHо) реакции разложения 2 молей йодистого водорода на простые вещества, если 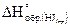 =26 кДж/моль.
=26 кДж/моль.
15. Сколько выделится теплоты при сжигании 1 кг алюминия, если 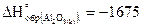 кДж/моль.
кДж/моль.
16. При сжигании какого количества магния выделяется 1000 кДж, если 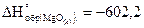 кДж/моль?
кДж/моль?
17. Сколько тепла выделяется при разложении 260 г ацетилена  на простые вещества, если
на простые вещества, если 
= 226, 9 кДж/моль?
18. Сколько тепла выделится при разложении 4, 4 г оксида азота (I) на азот и кислород, если 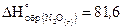 кДж/моль.
кДж/моль.
19. При взаимодействии 10 г водорода с хлором выделяется 920 кДж. Чему равна энтальпия образования 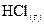 ?
?
20. Вычислите энтальпию образования оксида фосфора (V), если при сгорании 4 г фосфора выделяется 97, 2 кДж.
21. При разложении 3 г оксида азота (II) на простые вещества выделяется 9, 13 кДж. Определите 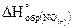 .
.
22. Определите тепловой эффект  реакции 2Mg(к)+CO2(г)=2MgO(k)+C(k), если
реакции 2Mg(к)+CO2(г)=2MgO(k)+C(k), если  кДж/моль и
кДж/моль и 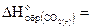
= -393, 5кДж/моль. Вычислите, сколько потребуется теплоты для сгорания 2, 4 г магния в диоксиде углерода.
23. Сероуглерод сгорает согласно уравнению
CS2(ж) + 3O2(г) = CO2(г) + 2SO2(г), 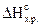 = -1103 кДж.
= -1103 кДж.
Рассчитайте стандартную энтальпию образования сероуглерода, если  кДж/моль и
кДж/моль и  кДж/моль.
кДж/моль.
Вычислите, сколько теплоты выделится при сгорании 150 г сероуглерода.
24. Определите  стандартную энтальпию химической реакции
стандартную энтальпию химической реакции
4NH3(г) + 5О2(г) = 4NO(г) + 6H2O(ж), если 
= 91, 3 кДж/моль,  кДж/моль и
кДж/моль и  кДж/моль.
кДж/моль.
Рассчитайте, сколько выделится теплоты при окислении
44, 8 л (н.у.) аммиака.
25. Рассчитайте стандартную энтальпию образования пероксида водорода 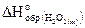 , если его разложение происходит по реакции
, если его разложение происходит по реакции 
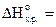
= -196, 4 кДж, а  кДж/моль.
кДж/моль.
Сколько выделится теплоты при разложении 100 г пероксида водорода?
26. Рассчитайте, сколько потребуется теплоты для получения 650 г цинка по реакции ZnO + C = Zn + CO, если 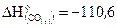 кДж/моль, а
кДж/моль, а
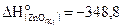 кДж/моль.
кДж/моль.
27.Рассчитайте стандартную энтальпию образования H2S(г), если при его сгорании по уравнению 2H2S(г)+3O2(г)=2H2O(г)+2SO2(г) выделяется 1037 кДж, а 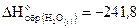 кДж/моль,
кДж/моль,
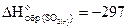 кДж/моль.
кДж/моль.
Вычислите, сколько тепла выделится при сгорании 11, 2 л (н.у.) H2S.
28.Сера сгорает в закиси азота (N2O) согласно уравнению 2N2O(г)+S(ромб.)=2N2(г)+SO2(г).
Сколько тепла выделится при сгорании 5 г ромбической серы в закиси азота, если  кДж/моль,
кДж/моль,
а  кДж/моль?
кДж/моль?