
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние природы реагирующих веществ.
|
|
Например: соляная кислота реагирует с цинком быстрее, чем уксусная кислота, т.к. соляная кислота - сильный электролит, а уксусная кислота -слабый; соляная кислота не реагирует с медью, а серная концентрированная реагирует, т.к. является сильным окислителем.
Скорость химических реакций пропорциональна площади соприкосновения реагирующих веществ.
Например: гранула цинка реагирует с соляной кислотой медленнее, чем цинковая пыль. Реакции в растворах протекают быстрее, чем между кристаллическими веществами, между газообразными веществами реакции протекают еще интенсивнее.
Катализ.
Катализаторы — это вещества, которые изменяют скорость реакции, но сами в конечном итоге остаются без изменения.
Катализаторы, ускоряющие хим. реакции называются положительными, а замедляющие - отрицательными или ингибиторами.
Реакции, протекающие в присутствии катализаторов, называются каталитическими или катализом.
Различают два вида катализа:
1. гомогенный (однородный) — это такой катализ, при котором реагирующие вещества и катализатор находятся в одной фазе, т.е. в одном агрегатном состоянии (газы или жидкость).
NO
2 SO2 + O2 = 2 SO3
Для гомогенного катализа установлено, что скорость хим. реакции пропорциональна концентрации катализатора.
2. гетерогенный (неоднородный) — это такой катализ, при котором реагирующие вещества и катализатор находятся в разных фазах, т.е. в разных агрегатных состояниях.
V2O5
2 SO2 + O2 = 2 SO3
Обычно катализатор является твердым веществом, а реагирующие вещества газами или жидкостями.
Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность катализатора будет зависеть и от свойств его поверхности (величины, химического состава, строения и состояния).
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ.
K NO
A + B = AB 2 SO2 + O2 = 2 SO3
A + K = AK 2 NO + O2 = 2 NO2
AK + B = AB + K NO2 + SO2 = SO3 + NO
V2O5
2 SO2 + O2 = 2 SO3
SO2 + V2O5 = SO3 + 2VO2
4 VO2 + O2 = 2 V2O5
Очень большую роль играет катализ в биологических системах. Большинство химических реакций, протекающих в пищеварительной системе, в крови и в клетках животных и человека, являются каталитическими реакциями. Катализаторы, называемые в этом случае ферментами, представляют собой простые или сложные белки с большим молекулярным весом. Их каталитическое действие отличается двумя исключительными свойствами:
1. способностью ускорять химическую реакцию в миллиарды раз
2. высокой избирательной способностью (из сотен возможных реакций катализируют только одну)
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами: соединения мышьяка, ртути, свинца, цианиды.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются. Эти вещества называются промоторами (промотирование платиновых катализаторов добавками железа, алюминия и др.).
Химическое равновесие.
Различают обратимые и необратимые реакции.
Необратимые реакции - реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества.
Обычно к необратимым реакциям относят реакции ионного обмена, при протекании которых:
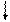 1. один из образующихся продуктов уходит из сферы реакции — выпадает в виде осадка, выделяется в виде газа:
1. один из образующихся продуктов уходит из сферы реакции — выпадает в виде осадка, выделяется в виде газа:
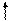 ВaCl2 + H2SO4 = ВaSO4 + 2 HCl
ВaCl2 + H2SO4 = ВaSO4 + 2 HCl
Na2CO3 + 2 HCl = 2 NaCl + CO2 + H2O
2. образуется малодиссоциирующее соединение:
HCl + NaOH = H2O + NaCl
3. реакции разложения
t
2KClO3 = 2KCl +3O2
Обратимыми реакциями называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
N2 + 3 H2 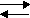 2 NH3
2 NH3
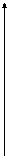
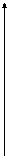 V
V
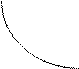 |
V1
V1 = V2
 |
V2
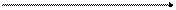 t
t
На рисунке показано изменение скоростей прямой и обратной реакций с течением времени. Вначале, при смешивании исходных веществ, скорость прямой реакции V1 велика, а скорость обратной реакции V2 равна нулю. По мере протекания реакции, исходные вещества расходуются и их концентрации уменьшаются. В результате этого уменьшается скорость прямой реакции V1. Одновременно появляются продукты реакции, и их концентрация возрастает. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие.
В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется динамическим равновесием. Его легко сместить как в сторону прямой, так и обратной реакции.
При химическом равновесии концентрации всех реагирующих веществ - как исходных, так и образующихся - остаются строго постоянными.
На состояние химического равновесия оказывают влияние:
а) концентрация реагирующих веществ
б) температура
в) давление (для газообразных веществ)
При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ будет изменяться до тех пор, пока не установится новое равновесие.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (для газов) определяется общим положением, которое называют принципом Ле-Шателье или принципом подвижного равновесия:
« Если на систему, находящуюся в равновесии, производится какое либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет данное воздействие».
Понятие «равновесие» означает состояние, в котором сбалансированы все противоположно направленные на систему воздействия. Принцип подвижного равновесия справедлив как для химических, так и для физических процессов.
1. Нарушение равновесия при изменении концентрации какого-либо вещества, участвующего в реакции.
С увеличением концентрации реагирующих веществ, химическое равновесие смещается в сторону продуктов реакции, т.е. в сторону образующихся веществ.
FeCl3 + 3 KCNS  Fe(CNS)3 + 3 KCl
Fe(CNS)3 + 3 KCl
Увеличение концентрации хлорида железа (III) или роданида калия приводит к смещению равновесия в сторону роданида железа (III) кроваво-красного цвета.
2 SO2 + O2  2 SO3
2 SO3
2. Изменение давления (только для газов)
С увеличением давления химическое равновесие смещается в сторону меньшего объема, т.е. в сторону меньшего числа молекул:
N2 + 3 H2  2 NH3
2 NH3
4 объема 2 объема
повышение давления
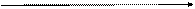 |
Если же в уравнении обратимой реакции число молей в левой части равно числу молей в правой части N2 + O2  2 NO, то изменение давления не вызывает смещения химического равновесия.
2 NO, то изменение давления не вызывает смещения химического равновесия.
3. Изменение температуры.
С увеличением температуры химическое равновесие смещается в сторону эндотермической реакции, т.е. в сторону реакции, идущей с поглощением тепла.
t
CaCO3  CaO + CO2 - Q 2 SO2 + O2
CaO + CO2 - Q 2 SO2 + O2  2 SO3 + Q
2 SO3 + Q
 повысить температуру понизить температуру
повысить температуру понизить температуру
Катализаторы не оказывают влияние на смещение химического равновесия, т.к. они одновременно изменяют как скорость прямой, так и скорость обратной реакций.
Состояние химического равновесия характеризуется константой равновесия.
Если реакция протекает согласно уравнения nА + mВ = pС + qD, то
[ C ] p [ D ]q
 К =
К =
[ A ]n [ B ]m
[ C ] [ D ] [ A ] [ B ] – равновесные концентрации веществ, участвующих и
образующихся в результате реакции.
n, m, p, q – стехиометрические коэффициенты в уравнении реакции.