
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Раздел 1 общая и неорганическая химия
|
|
Тема 1.1 Основные понятия и законы химии
Сущность атомно-молекулярного учения заключается в следующем:
1. Все вещества состоят из молекул, атомов или ионов. Молекула является наименьшей частицей, которая сохраняет свойства данного химического соединения.
2. Молекулы находятся в постоянном движении. С повышением температуры скорость движения частиц увеличивается.
3. Молекулы различных веществ отличаются друг от друга массой, размерами, составом, строением и химическими свойствами.
4. Молекулы могут состоять из атомов как одного элемента, так и различных элементов.
Молекула – мельчайшая частица вещества, обладающая определенной массой и всеми химическими свойствами этого вещества.
Атомы – мельчайшие химически неделимые частицы, из которых состоят молекулы.
Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Атом состоит из положительно заряженного ядра и электронной оболочки. Ядро атома состоит из протонов и нейтронов. Число протонов = порядковому номеру химического элемента. S протонов и нейтронов = массовому числу (относительной атомной массе). Число электронов = заряду ядра атома и порядковому номеру элемента.
Пример: Cl17 р = 17
n = 35-17=18
l = 17
Изотопы – химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Химическая формула отдельного химического вещества обозначается химическим знаком элемента с индексом, указывающим число атомов в совокупности (Cl2, Br2, O2, N2). Это условная запись состава вещества, а индекс – цифра, стоящая справа внизу от символа химического элемента.
Химическая формула сложного вещества отражает, помимо его элементного состава, количественные соотношения между числом атомов различных элементов в молекуле (Н2О, С6Н12О6 , Р2О5).
Относительная молекулярная масса (Mr) – безразмерная величина, равная отношению абсолютной массы молекулы к 1/12 массе атома 12С углерода. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Молярная масса вещества (М) – отношение массы вещества к количеству вещества. Она показывает массу 1 моля вещества.
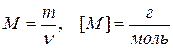 , где ν (n)– количество вещества.
, где ν (n)– количество вещества.
Количество вещества (ν, n) означает определенное число структурных элементов (молекул, атомов, ионов).
Моль – единица количества, содержащая столько же структурных единиц данного вещества, сколько атомов содержится в 12 г С, состоящего только из изотопа 12С.
 ν
ν
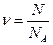
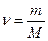
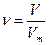
Постоянная Авогадро (NA) – число частиц в одном моле любого вещества одно и тоже и равно 6, 02∙ 1023 моль –1
Молярный объем газов (Vm) – отношение объема газа к количеству вещества, 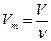 , при нормальных условиях t =273 К, р = 101 кПа, Vm = 22, 4 л/моль.
, при нормальных условиях t =273 К, р = 101 кПа, Vm = 22, 4 л/моль.
Относительная плотность газов (Д) – безразмерная величина, являющаяся отношением молярных масс равных объемов разных газов. Она показывает, во сколько раз 1 моль одного газа тяжелее (или легче) 1 моля другого газа. Относительная молекулярная масса воздуха составляет 29 г/моль.Плотности газов относятся друг к другу как их молярные массы.
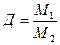
Задания для самоконтроля:
Задание № 1 Чему равна относительная молекулярная масса? Найдите Mr следующих веществ: NaNO3; K2SO4; NH4NO2; Al(OH)3; KAl(SO4)2.
Задание № 2. Какую массу будут иметь 0, 24 моль следующих веществ:
а) хлорида натрия, б) оксида алюминия, в) гидроксида калия, г) сульфата бария.
Задание № 3. Определите массовые доли элементов в следующих соединениях: а) CaCl2, б) H2SO4, в) FeCl2, г) MgCO3, д) KHS, е) Mn2O7. Оформите решение задачи.
Задание № 4. Водород и кремний соединяются в массовом отношении 1: 7. Определите формулу этого соединения водорода и кремния состава SixHy.
Задание № 5. Плотность неизвестного газа по воздуху равна 1, 17. Определите молярную массу газа.
Задание № 6. Нихромом называют сплав никеля с хромом, содержащий 80% никеля и 20% хрома. Его широко используют для изготовления электрических нагревательных приборов. Вычислите, сколько никеля содержит 0, 5 кг нихрома?
Задание № 7. Для наклеивания керамических плиток используется клей марки КЦК, который состоит из 70% цемента марки 400 и 30% кварцевого песка (SiO2). Перед употреблением измельченную смесь этих веществ заливают водой и тщательно перемешивают. Сколько надо взять цемента и песка для приготовления 100 кг такого клея?
Задание № 8. Для сварки металлов и получения ацетилена (С2Н2) используют карбид кальция, который содержит 37, 5% углерода. Выведите формулу карбида кальция.