
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Законы термодинамики. Энтропия
|
|
Вокруг нас происходят явления, внешне весьма косвенно связанные с механическим движением. Это явления, наблюдаемые при изменении температуры тел, представляющих собой макросистемы, или при переходе их из одного состояния (например, жидкого) в другое (твердое либо газообразное). Такие явления называются тепловыми.
Первые успехи на пути построения научной теории теплоты относятся к началу XVII в., когда был изобретен термометр и появилась возможность количественного исследования тепловых процессов и свойств макросистем. Вновь перед наукой встал вопрос: что же такое теплота? Наметились две противоположные точки зрения. Согласно одной из них — вещественной теории тепла — теплота рассматривалась как особого рода невесомая «жидкость», способная перетекать от одного тела к другому. Такая жидкость была названа теплородом. Чем больше теплорода в теле, тем выше температура тела. Приверженцы другой точки зрения полагали, что теплота - это вид внутреннего движения частиц тела. Чем быстрее движутся частицы тела, тем выше его температура. Таким образом, представление о тепловых явлениях и свойствах связывалось с атомистическим учением древних философов о строении вещества. В рамках подобных представлений теорию тепла первоначально называли корпускулярной (от слова «корпускула» - частица). Ее придерживались Ньютон, Гук, Бойль, Бернулли и др.
Большой вклад в развитие корпускулярной теории тепла сделал М.В. Ломоносов, рассматривавший теплоту как вращательное движение частиц вещества. С помощью своей теории он объяснил в общем процессы плавления, испарения и теплопроводности, а также пришел к выводу о существовании «наибольшей или последней степени холода», когда движение частичек вещества прекращается. Благодаря работам Ломоносова среди русских ученых было очень мало сторонников вещественной теории теплоты.
И все же, несмотря на многие преимущества корпускулярной теории теплоты, к середине XVIII в. временную победу одержала теория теплорода. Это произошло после экспериментального доказательства сохранения теплоты при теплообмене, что послужило основанием для вывода о сохранении (неуничтожении) тепловой жидкости - теплорода. С помощью введенного понятия теплоемкости тел удалось создать количественную теорию теплопроводности. Многие термины, введенные в то время, сохранились доныне.
В середине XIX в. установлена связь между механической работой и количеством теплоты. Подобно механической работе, количество теплоты оказалось мерой изменения энергии. Нагревание тела связано не с увеличением в нем количества особой невесомой «жидкости», а с увеличением его энергии. Теплота представляет собой форму энергии. Принцип теплорода был вытеснен фундаментальным законом сохранения энергии.
Значительный вклад в развитие теории тепловых явлений и свойств макросистем внесли немецкий физик Р. Клаузиус (1822-1888), английский физик-теоретик Дж. Максвелл, австрийский физик Л. Больцман (1844-1906) и др.
Всякая термодинамическая система в любом состоянии обладает внутренней энергией - энергией теплового (поступательного, вращательного и колебательного) движения молекул и потенциальной энергией их взаимодействия. Возможны два способа изменения внутренней энергии термодинамической системы при ее взаимодействии с внешними телами: совершение работы и теплообмен.
Известно, что в процессе превращения энергии действует закон сохранения механической энергии. Поскольку тепловое движение тоже механическое (только не направленное, а хаотическое), то при всех превращениях должен выполняться закон сохранения энергии не только внешних, но и внутренних движений. Данное утверждение составляет основу первого начала термодинамики:
количество теплоты ∆ Q, сообщенное телу, идет на увеличение его внутренней энергии ∆ U и на совершение телом работы ∆ А, т.е.
∆ Q = ∆ U + ∆ А.
Из первого начала термодинамики следует важный вывод: невозможен вечный двигатель первого рода, т.е. такой двигатель, который совершал бы работу «из ничего», без внешнего источника энергии. При наличии внешнего источника часть энергии неизбежно переходит в энергию теплового, хаотического движения молекул, что и является причиной невозможности полного превращения энергии внешнего источника в полезную работу.
Многочисленные опыты показывают, что все тепловые процессы в отличие от механического движения необратимы, т.е. для них обратные процессы, при которых реализуются те же тепловые состояния, но только в обратном направлении, практически невозможны. Другими словами, термодинамические процессы необратимы. Приведем два характерных примера необратимых процессов. Если привести в соприкосновение два тела с различной температурой, то более нагретое тело будет отдавать тепло менее нагретому. Обратный процесс — самопроизвольный переход тепла от менее нагретого тела к более нагретому - никогда не произойдет. Столь же необратимым является и другой процесс - расширение газа в пустоту. Газ, находящийся в части сосуда, отдаленной от другой части перегородкой, после ее удаления заполняет весь сосуд. Без постороннего вмешательства газ никогда не соберется самопроизвольно в той же части сосуда, где он находился первоначально.
Всякая предоставленная самой себе система стремится перейти в состояние термодинамического равновесия, в котором тела находятся в состоянии покоя по отношению друг к другу, обладая одинаковыми температурой и давлением.
Равенство температур во всех точках есть условие равновесия двух систем или двух частей одной и той же системы.
Это положение называется нулевым началом термодинамики. Достигнув равновесия, система сама по себе из него не выходит. Значит, все термодинамические процессы, приближающиеся к тепловому равновесию, необратимы. Необратимы и все механические процессы, сопровождающиеся трением. Трение вызывает замедление движения тел, при котором кинетическая энергия переходит в тепло. Замедление эквивалентно приближению к состоянию равновесия, при котором движение тел отсутствует.
В системе тел, находящихся в термодинамическом равновесии, без внешнего вмешательства невозможны никакие реальные процессы. Следовательно, с помощью тел, находящихся в термодинамическом равновесии, невозможно совершить никакой работы, так как работа связана с механическим движением, т.е. с переходом тепловой энергии в кинетическую. Утверждение о невозможности получения работы за счет энергии тел, находящихся в термодинамическом равновесии, лежит в основе второго начала термодинамики.
Окружающая нас среда обладает колоссальным запасом тепловой энергии. Двигатель, работающий только за счет энергии находящихся в тепловом равновесии тел, был бы практически вечным двигателем. Второе начало термодинамики исключает возможность создания такого вечного двигателя второго рода.
Необратимость тепловых процессов имеет вероятностный характер. Самопроизвольный переход тела из равновесного состояния в неравновесное не невозможен, а лишь весьма маловероятен. В конечном результате необратимость тепловых процессов обусловливается колоссальностью числа молекул, из которых состоит тело.
Молекулы газа стремятся к наиболее вероятному состоянию, т.е. к состоянию с беспорядочным распределением молекул, при котором примерно одинаковое число молекул движется вверх и вниз, вправо и влево, причем в каждом объеме находятся примерно одинаковое число молекул, одинаковая доля быстрых и медленных молекул в верхней и нижней частях какого-либо сосуда. Любое отклонение от такого беспорядка, хаоса, т.е. от равномерного и беспорядочного перемешивания молекул по местам и скоростям, связано с уменьшением вероятности, или представляет собой менее вероятное событие. Напротив, процессы, связанные с перемешиванием, с созданием хаоса из порядка, увеличивают вероятность состояния. Только при внешнем воздействии возможно рождение порядка из хаоса, при котором порядок вытесняет хаос. В качестве примеров, демонстрирующих порядок, можно привести созданные природой минералы, построенные человеком большие и малые сооружения и т.п.
Количественной характеристикой теплового состояния системы является термодинамическая вероятность W, равная числу микроскопических способов, с помощью которых это состояние может быть достигнуто. Система, предоставленная самой себе, стремится перейти в состояние с большим значением W. Принято пользоваться не самой вероятностью W, а ее логарифмом, который еще умножается на постоянную Больцмана к. Определенную таким образом величину
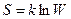
называют энтропией системы. Эта формула высечена на памятнике Больцману.
Обсуждая принцип Больцмана, немецкий физик и математик А. Зоммерфельд (1868—1951) писал: «Высеченная на памятнике Больцману на Венском кладбище эта формула парит на фоне облаков над могилой великого Больцмана. Неважно, что сам Больцман никогда не писал этой формулы. Это сделал Планк в первом издании лекций по теории теплового излучения (1906). Планку же принадлежит введение постоянной к. Сам Больцман говорил только о пропорциональности между энтропией и логарифмом вероятности состояния. Термин «принцип Больцмана» был введен Эйнштейном». Возрастание энтропии для необратимых процессов есть следствие перехода системы от менее вероятного состояния к более вероятному, при этом состояние равновесия выступает как наиболее вероятное.
Второе начало термодинамики, определяющее направление тепловых процессов, формулируется как закон возрастания энтропии:
для всех происходящих в замкнутой системе тепловых процессов энтропия системы возрастает; максимально возможное значение энтропии замкнутой системы достигается в тепловом равновесии:
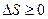
Идеальному случаю - полностью обратимому процессу замкнутой системы - соответствует неизменяющаяся энтропия. Все естественные процессы происходят так, что вероятность состояния возрастает, что означает переход от порядка к хаосу. Значит, энтропия характеризует меру хаоса, которая для всех естественных процессов возрастает. В этой связи закон о невозможности вечного двигателя второго рода, закон о стремлении тел к равновесному состоянию получает свое объяснение - почему механическое движение переходит в тепловое. Да потому, что механическое движение упорядочено, а тепловое беспорядочно, хаотично.
При абсолютном нуле температуры энтропия принимает значение, не зависящее от давления, агрегатного состояния и других характеристик вещества. Такое значение можно положить равным нулю.
Это утверждение называется тепловой теоремой, впервые сформулированной немецким физико-химиком В.Г. Нернстом (1864-1941), лауреатом Нобелевской премии по физике 1920 г. Теорема Нернста не вытекает из первых двух начал, поэтому в силу своей общности она рассматривается как третье начало термодинамики.
Теоремой Нернста завершается построение классической термодинамики.