
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теплоемкость, энтальпия и энтропия
|
|
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T:
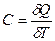
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Массовая теплоёмкость (С) — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг− 1·К− 1).
Объёмная теплоёмкость (С′) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м− 3·К− 1).
Молярная теплоёмкость (С μ ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
Количество теплоты определяется по формуле:
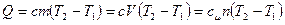
Теплоемкость зависит от характера процесса и свойств газа. В зависимости от способа подвода теплоты различают теплоемкость при постоянном давлении (изобарную) ср и теплоемкость при постоянном объеме (изохорную) сv.
Т.к. теплоемкость изменяется с теипературой, в зависимости от интервала температур различают истинную (с) и среднюю (сm) удельные теплоемкости. Истинной называют теплоемкость, соответствующую бесконечно малому интервалу температур: c=dq/dT, а средней – теплоемкость, соотвествующую конечному интервалу изменения температуры: cm=q/(T2-T1).
Энтальпия. В ряде случаев оказывается целесообразным объединение параметров u и pv в общий калорический параметр, называемый энтальпией:
i=u+pv, Дж/кг.
Энтальпия – термодинамическая функция, имеющая смысл полной (внутренней и внешней) энергии системы. Она складывается из внутренней энергии u и упругости энергии pv, обусловленной наличием внешнего давления окружающей среды p, т.у. pv есть работа, которую надо затратить, чтобы ввести рабочее тело объемом v в среду, имеющую давление p.
u=cvT; pv=RT
Энтропия. Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения её частиц.
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение общего количества тепла  к величине абсолютной температуры
к величине абсолютной температуры  (то есть тепло, переданное системе, при постоянной температуре):
(то есть тепло, переданное системе, при постоянной температуре):
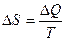 .
.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся выделением тепла, вследствие изменения структуры.
Рудольф Клаузиус дал величине  имя «энтропия», происходящее от греческого слова τ ρ oπ ή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
имя «энтропия», происходящее от греческого слова τ ρ oπ ή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
Эта формула применима только для изотермического процесса (происходящего при постоянной температуре). Её обобщение на случай произвольного квазистатического процесса выглядит так:
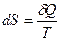 ,
,
Где dS — приращение (дифференциал) энтропии некоторой системы, а 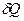 — бесконечно малое количество теплоты, полученное этой системой.
— бесконечно малое количество теплоты, полученное этой системой.