
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вычисление рН буферных растворов Уравнение Гендерсона -Хассельбаха
|
|
1) Аналитическое выражение для расчета рН буферного раствора, например, ацетатного буфера можно получить из уравнения для константы диссоциации (к реакциям диссоциации применим закон действующих масс).
 ,
,
разрешив его относительно концентрации ионов водорода [H+] можно написать:
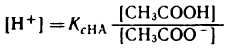
Уксусная кислота присутствует в растворе в смеси с CH3COONa в виде неионизированных молекул. Поэтому концентрацию молекул можно принять равной общей молярной концентрации кислоты в растворе, т. е. [СН3СООН] = Скисл. Концентрацию анионов уксусной кислоты можно принять равной концентрации соли, т. е. [СН3СОО-] = С соли, так как CH3COONa— сильный электролит, диссоциирующий в растворе на 100%. Приняв эти упрощения, получим:

2. Логарифмируя полученное уравнение и заменяя знаки логарифмов на обратные, получаем:

но – I g [Н+] есть рН, а – I g К есть рК — силовой показатель кислоты.
С учетом этого получим:
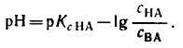 Это уравнение называют уравнением буферного раствора (или уравнением Гендерсона-Гассельбаха).
Это уравнение называют уравнением буферного раствора (или уравнением Гендерсона-Гассельбаха).
Если при приготовлении буферной системы взять одинаковые концентрации кислоты и соли, то концентрация ионов водорода в таком растворе будет равна константе ионизации кислоты, так как отношение Скис/Ссоли = 1 и [Н+]=К1, т.е. [Н+]=К, поэтому рН=рК.
Аналогично для систем NH4OH + NH4C1получают выражения:
1. Запишем уравнение константы ионизации NH4OH и найдем [ОН-]:

2. Отсюда находим:
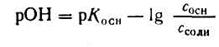
Зная, что рН + рОН = 14, получим:

Задача 1. Сколько 0, 5 М раствора CH3COONa нужно прибавить к 100 мл 2М раствора СН3СООН, чтобы получить буферный раствор с рН=4?
Решение:

Откуда 
Подставляем числовые данные и получаем:

Число Ig 0, 76 = 5, 754. Следовательно, отношение концентрации кислоты к концентрации соли должно быть равно 5, 754: 1.
2. Находим концентрацию кислоты в буферной системе:

3. Зная концентрацию кислоты, находим концентрацию солив буферной системе; она должна быть равна 0, 2: 5, 754= 0, 03475 (моль).
4. Находим количество 0, 5 М раствора ацетата натрия, содержащего 0, 03475 моль:
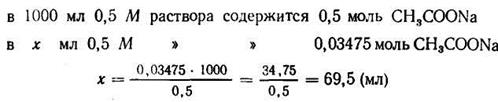
Задача 2. Вычислить рН аммиачной буферной системы, содержащей по 0, 5 М NH4ОН и NH4C1. Как изменится рН при добавлении к 1 л этой смеси 0, 1 М НС1 и при добавлении к 1 л этой смеси 0, 1 М NaOH и при разбавлении раствора водой в 10 раз, если рК (NH4ОН) =4, 75?