
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Обеззараживание воды хлорированием
|
|
Теоретические сведения
Обеззараживанием воды называется процесс её очистки от патогенных микроорганизмов в процессе водоподготовки.
Существует два основных метода обеззараживания:
- реагентный, при котором вода обрабатывается сильными окислителями (озоном, хлором, хлораминами, хлорной известью, перманганатом калия), солями меди или серебра;
- безреагентный, при котором вода подвергается воздействию ультрафиолетового облучения (УФО), ультразвука или высокой температуры (кипячение воды).
Сущность процесса обеззараживания заключается в окислении веществ, входящих в состав протоплазмы клеток, что приводит к инактивации ферментов и гибели бактерий.
При полной очистке поверхностных вод обеззараживание необходимо всегда, при использовании подземных вод – только тогда, когда микробиологические свойства воды не соответствуют требованиям СанПиН 2.1.4.559-96 (в случае централизованного водоснабжения) и СанПиН 2.1.4.544-96 (для источников нецентрализованного водоснабжения).
Для профилактического обеззараживания и обработки воды в аварийных ситуациях процесс обеззараживания необходим на всех станциях подготовки хозяйственно-питьевых вод.
Часть окислителей при подаче в воду расходуется на окисление некоторых органических и минеральных веществ, что улучшает органолептические свойства воды (цвет, запах, привкус). Наличие взвешенных веществ в воде препятствует контакту клеток микроорганизмов с реагентом и тем самым снижает эффективность обеззараживания.
Наиболее распространенным методом обеззараживания является хлорирование – обработка воды одним из хлорсодержащих соединений: жидким хлором (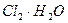 ), хлорной известью (CaOCl2), гипохлоритами кальция (Ca(ClO)2) и натрия (NaClO), хлораминами (NH2Cl, NHCl2). Все эти соединения, а также продукты их гидролиза – хлорноватистая кислота (HClO) и атомарный кислород, образующийся при разложении хлорноватистой кислоты, обладают сильным бактерицидным действием.
), хлорной известью (CaOCl2), гипохлоритами кальция (Ca(ClO)2) и натрия (NaClO), хлораминами (NH2Cl, NHCl2). Все эти соединения, а также продукты их гидролиза – хлорноватистая кислота (HClO) и атомарный кислород, образующийся при разложении хлорноватистой кислоты, обладают сильным бактерицидным действием.
В процессе обеззараживания воды хлором протекают следующие реакции:
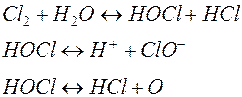
Степень диссоциации зависит от реакции среды (рН): чем ниже значение рН, тем выше концентрация хлорноватистой кислоты, при рН = 6, 5-8, 5 в воде присутствует и хлорноватистая кислота и гипохлорит.
При хлорировании воды различают «активный хлор» и «остаточный хлор». Под «активным хлором» условно понимают количество газообразного хлора, эквивалентное кислороду, выделяющемуся при гидролизе хлорирующих веществ. «Остаточным хлором» условно называют то количество газообразного хлора, которое остается в воде после уничтожения микробов и окисления органических и неорганических веществ, при этом Cl2, HClO и ClO- образуют свободный хлор, а NH2Cl и NHCl2 – связанный хлор.
Необходимая доза хлора определяется по кривой хлоропоглащаемости воды и концентрации «остаточного хлора» (мг/л) в зависимости от дозы введенного хлора (мг/л). Пример кривой хлоропоглащаемости воды представлен на рис.1.
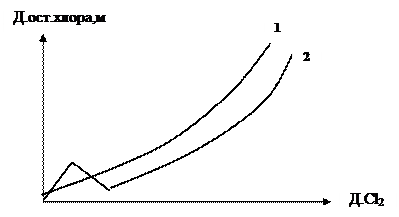 |
Рис.1. Кривые хлоропоглащаемости воды:
1 – в отсутствии соединений NH4+;
2 – при наличии в воде аммонийных соединений.
Присутствие в воде соединений азота изменяет кривую хлоропоглащаемости. В этом случае вводимый хлор вступает в реакции окисления аминов:
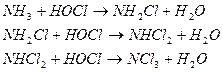
С увеличением рН воды меньшее количество хлора связывается в дихлорамины, а при рН = 8 в воде присутствуют только монохлорамины. По мере увеличения количества введенного в воду хлора будет все с большей интенсивностью происходить окисление моно- и дихлораминов. При дозе 10мг Cl2 на 1мг N (в виде NH4+) все хлорамины оказываются окисленными. Гидролиз хлораминов протекает медленнее, чем свободного хлора, поэтому вначале содержание «остаточного хлора» увеличивается, а затем уменьшается. Точка минимума на кривой соответствует полному разложению соединений хлора и азота.
Количество хлора, необходимое для разрушения хлораминов, обычно в 10-20 раз превышает концентрацию аммонийных соединений в воде.
Различают хлорирование до точки перелома, когда в воде находится хлор в виде NH4Cl. Обработка большими дозами – хлорирование за точкой перелома сопровождается присутствием в воде свободного активного хлора. Обычно вода для питьевых нужд хлорируется малыми дозами, а для обеззараживания сточных вод (хозяйственно-бытовых, коммунальных, ливневых, промышленных) используют большие дозы с ведением процесса до перехода точки перелома и полного разрушения хлораминов.
Оптимальной считается доза, которая обеспечит в воде концентрацию «остаточного хлора» в соответствии с требованиями СанПиН «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль за качеством»:
-0, 3-0, 5 мг/л свободного хлора при времени контакта 30 мин;
-0, 8-1, 2 мг/л связанного хлора при времени контакта 60 мин.
Кроме хлорирования, используется метод обработки воды ультрафиолетовыми лучами. УФ-лучи длинной волны 220-280 нм действуют на бактерии губительно, причем максимум бактерицидного действия соответствует длине волны 260 нм. При действии УФ-лучей на бактериальные клетки происходит поглощение квантов света нуклеиновыми кислотами ядра клетки и нарушение в результате этого процессов биосинтеза белка. Источниками УФ-лучей является ртутно-аргонная или ртутно-кварцевая лампа. Бактерицидный эффект ультрафиолетовых лучей резко снижается при содержании в воде взвешенных веществ свыше15 мг/л, поэтому вода, подвергающаяся обеззараживанию, должна быть прозрачной и бесцветной.
Преимущество этого способа обеззараживания перед хлорированием заключается в том, что одинаково поражаются вегетативные тела бактерий и споры, при этом состав облучаемой воды не меняется и вода не приобретает дополнительных запахов и привкусов.
После обеззараживания содержание микробиологических и паразитологических показателей в питьевой воде должно соответствовать требованиям СанПиН (Табл.1).
Таблица 1.
| Показатели | Единицы измерения | Нормативы |
| Термотолерантные колиформные бактерии | Число бактерий в 100мл | Отсутствие |
| Общие колиформные бактерии | Число бактерий в 100мл | Отсутствие |
| Общее микробное число 2) | Число образующих колонии бактерий в 1 мл | Не более 50 |
| Колифаги | Число бляшкообразующих единиц (БОЕ) в 100 мл | Отсутствие |
| Споры сульфитредуцирующих клостридий | Число спор в 20 мл | Отсутствие |
| Цисты лямблий | Число цист в 50 л | Отсутствие |