
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция № 4
|
|
Тема:
«Химиотерапия инфекционных болезней. Антибиотики. Микробиология внутрибольничных инфекций»
Вопросы:
Основные группы антимикробных химических веществ. Антибиотики. Осложнения антибиотикотерапии. Меры борьбы с лекарственной устойчивостью микроорганизмов. Особенности химиотерапии вирусных инфекций.
Действие физических, химических и биологических факторов на микроорганизмы. Понятия дезинфекция и стерилизация. Определение понятия внутрибольничная инфекция (ВБИ). Причины возникновения ВБИ. Роль медицинской сестры в профилактике ВБИ.
АНТИБИОТИКИ
Антибиотики (anti - против, bios - жизнь) - химиотерапевтические вещества с избирательным спектром этиотропного (паразитотропного) действия, которые в ничтожно малых концентрациях подавляют размножение или вызывают гибель патогенных микробов и опухолевых клеток.
В лечебных дозах они не оказывают органотропного (токсического) влияния на организм. Эффективность (ценность) этиотропных препаратов вычисляется по химиотерапевтическому индексу. Определяют его двояким образом: делением степени паразитотропности на органотропность или наоборот. Лучшими препаратами в первом случае вычисления считаются те из них, у которых индекс бесконечно велик, а во втором - бесконечно мал. Кроме лечения инфекционных болезней (химиотерапия), антибиотики применяются для их профилактики (химиопрофилактика) и в борьбе с микробоносительством (химиосанация).
История химиотерапии. Специфически действующие на патогенные микробы лекарственные вещества были случайно найдены задолго до бактериологической эры. Так, хинную кору как лечебное средство против малярии с незапамятных времен использовали индейцы Перу, ртуть как антисифилитическое средство — арабы, а корень ипекакуаны как препарат против амебной дизентерии -древние жителя Бразилии.
Основателем научной и практической химиотерапии является немецкий ученый П. Эрлих, плодотворные исследования которого завершились в 1909 г. синтезом сальварсана, а затем - менее токсичного новарсенола, составивших эпоху в лечении сифилиса, фрамбезии, возвратного тифа и сибирской язвы. Вслед за мышьяковистыми препаратами, созданными Эрлихом на основе атоксила, в первой четверти XX в. были синтезированы атебрин, препараты сурьмы, висмута, обладающие протистоцидными свойствами.
Знаменательным в истории химиотерапии явился 1932 г., когда Г. Домагк доказал, что красный пронтозил обладает не просто ингибирующим, а бактерицидным (губительным) действием на гноеродные кокки.
Бурное развитие антибиотикотерапии бактериальных инфекций началось после того, как в 40-х гг. XX в. X. Флори и Э. Чейн из зеленой плесени, полученной А. Флемингом (1929), выделили кристаллический бензил-пенициллин, и после исследований С. Ваксмана, который из актиномицетов выделил стрептомицин. Намеченные ими пути поисков антибиотиков и предложенные Эрлихом способы их синтеза завершились созданием целого арсенала антимикробных средств в химиотерапии практически всех инфекционных болезней и лечении многих опухолей.
Классификация антибиотиков. По источнику и способу получения антибиотики подразделяют на природные, синтетические и полусинтетические, а по объекту действия - на антибактериальные, антигрибковые, антипаразитарные, антивирусные. При этом основным природным источником их получения являются почвенные микроорганизмы. Сравнительно редко используются антибиотики животного происхождения, в качестве которых можно привести интерфероны (см. «Принципы иммунотерапии»), и антибиотики растений (фитонциды), большинство из которых, являясь летучими эфирными соединениями, при изготовлении и хранении быстро утрачивают антимикробную активность.
По химической структуре различают 12 групп антибиотиков: fi-лактамы, основой молекул которых является 4-членное Р-лактамное кольцо; полиены (нистатин, лево-рин, амфотерицин В, антимикоин); аминогликозиды, в которых аминосахара соединены гликозидазной связью с агликоновым фрагментом; тетрациклины, в основе структуры которых лежит 4-циклическая углеводородная (тетрациклиновая) система; макролиды, молекулу которых составляет макроциклическое лактоновое кольцо; левоми-цетин (левовращающая фракция хлорамфеникола); антибиотики сборной группы (рифамицины, линкосамиды, ак-тиномицины, полимиксины и др.); сульфаниламиды (производные парааминобензолсульфамида); изониазиды (гид-разиды изоникотиновой кислоты); хинолоны (налидиксо-вая кислота, циноксацин) и фторхинолоны (пефлоксацин, профлоксацин и др.); нитрофураны (фурацилин, фурагин).
Механизм антимикробного действия антибиотиков
β -лактамы, включающие бензилпенициллин с его многочисленными аналогами, цефалоспорины, полученные из грибов рода Cephalosporium, а также устойчивые к микробным р-лактамазам карбопенемы и монобактамы избирательно угнетают синтез пептидогликана. Лишившись основного компонента клеточной стенки, бактерии погибают от осмотического шока, а при образовании L-форм -приобретают к ним высокую степень резистентности вследствие утраты рецепторов. Аналогично проявляется антимикробное действие полимиксинов и других антибиотиков бактериального происхождения. Ванкомицин и близкие ему по природе антибиотики, имеющие трубчатую структуру, «перфорируют» стенку бактерий.
Полиены тоже нарушают целостность клеток, ингибируя, правда, не бактерии, а грибы, микоплазмы и, в меньшей степени, простейшие. Связываясь с их мембранными стери-нами, они повышают проницаемость мембран, что ведет к утрате жизненно важных метаболитов цитоплазмы. Полиены ингибируют также опухолевые клетки, содержащие намного большее количество стеринов, чем у микоплазм, грибов и простейших. Установлено, что полиены снижают токсическое действие цитостатиков и в комбинации с актиномицина-ми усиливают их противоопухолевый эффект. Пол иены можно применять для связывания свободных стеринов крови при нарушении холестеринового обмена.
Аминогликозиды всех трех поколений (кана- (1-е), гента-, сизо- (2-е), амика-, нетилмицин (3-е) и близкий им стрептомицин), тетрациклины (тетра- и окситетрацик-лин), макролиды (эритро- и олеандомицин), левомицетин нарушают синтез белка. При этом левомицетин реагирует с пептидилтрансферазным центром рибосом в 50S субъединице, инактивируя энзиматическую систему, катализирующую образование пептидных связей белков. Макролиды и линкомицин фиксируются вблизи левомицетина и тетрациклина, аминогликозиды - на 30S субъединице рибосом. Кроме того, аминогликозиды и тетрациклины ин-гибируют синтез НК.
Антибиотики сборной группы - рифамицины, рифампицин - вызывают элиминацию R-плазмид, а эритромицин, полимиксины - блокируют их передачу; актиномици-ны и другие антибиотики с противоопухолевым и антивирусным эффектом действия так же, как митомицин, проникая в опухолевую клетку, образуют поперечные или перекрестные связи между комплементарными нитями ДНК.
Сульфаниламиды (сульфатиазол, сульфадимидин, сульфадиметоксин, сульфален и др.), будучи антиметаболитами парааминобензойной кислоты, захватываются бактериями и блокируют образование фолиевой кислоты, являющейся коферментом в реакциях биосинтеза аминокислот, азотистых оснований и витаминов, а изониазиды (фтивазид, метазид, опиниазид), проникнув в клетки, трансформируются в изоникотиновую кислоту, которая замещает никотиновую в коферменте 1, что приводит к ингибированию синтеза НК, белков и липидов у микобактерий туберкулеза.
Хинолоны связывают ионы металлов (в том числе Fe), необходимые для активации ферментных систем бактерий, амеб и некоторых грибов, а фторхинолоны - блокируют фермент ДНК-гиразу, в результате чего происходит сверхскручивание ДНК, гидролиз АТФ, нарушение проницаемости мембраны и лизис микробов. Таким же эффектом действия обладают нитрофураны, но клеточную стенку микробов они повреждают, блокируя НАД-Н, цикл трикар-боновых кислот и ряд других биохимических процессов.
Полусинтетические антибиотики. Расшифровав структуру антибиотиков, химики разработали ряд синтетических способов их получения, но самым надежным из них оказался уже испытанный в прошлом при синтезе сальварсана и новарсенола «принцип химических вариаций»
Эрлиха, основанный на частичном изменении исходной молекулы путем замещения в ней соответствующих радикалов на такие, которые повышают паразитотропность и снижают органотропность. Особенно большие успехи в этом направлении были достигнуты при получении полусинтетических аналогов бензилпенициллина. Заменяя в нем бензильную группу на остатки молекул других органических соединений, химики создали многие десятки полусинтетических пенициллинов, отличающихся от природного более широким спектром антимикробного действия, устойчивостью к бактериальным (3-лактамазам (пенициллиназе), соляной кислоте и ферментам желудочно-кишечного тракта. В частности, пенициллиназоустой-чивые оксациллин, клоксациллин, флуклоксациллин незаменимы при лечении гнойных инфекций, вызванных антибиотикорезистентными стафилококками. Ампициллин, карбенициллин, карфециллин, бакампициллин, ампиокс-натрий (оксациллин с ампициллином) и другие их комбинации в отличие от бензилпенициллина подавляют не только грамположительную, но и грамотрицательную микрофлору (синегнойную палочку, эшерихии, протей, гемофильные бактерии). Подобно этому на основе амино-цефалоспориновой кислоты были синтезированы цефа-лоспорины всех трех поколений, в частности цефалоридин и цефалексин (I), цефуроксим и цефокситин (II), цефтизоксим и цефоперазон (III).
Большими преимуществами обладают также производные тетрациклинов. Так, метациклин и доксициклин характеризуются лучшей всасываемостью, пролонгированным действием, большой лечебной эффективностью и практически не вызывают побочных реакций. Из рифампицина SV был получен рифампицин более активный, чем исходный препарат, в отношении грамотрицательных бактерий, а главное, один из самых эффективных туберкулостатических средств.
По конечному эффекту действия на бактерии антибиотики классифицируются на бактериостатики и бактерицидные препараты, т. е. угнетающие развитие бактерий и вызывающие их гибель. Бактерицидными свойствами обладают пенициллин и полусинтетические пенициллины, цефалоспорины и аминогликозиды. Другие группы антибиотиков оказывают бактериостатическое действие.
При этом их активность выражается в международных единицах. За единицу действия пенициллина принимают антибактериальную активность, которой обладает 0, 6 мкг стандартного бензилпенициллина. Единица действия других антибиотиков, которые вводятся парентерально, равнозначна 1 мкг сухого препарата.
Терапевтическая эффективность антибиотиков. Антимикробная эффективность антибиотиков определяется пролиферативной активностью культуры. Наиболее чувствительны к ним микробы в экспоненциальной фазе развития. В*лаг-фазе и стационарной фазе, в изотоническом растворе, при низких температурах, когда задерживаются процессы метаболизма, антибиотикочувствитель-ность бактерий резко снижается. В организме действие антибиотиков зависит от их связи с белками крови и тканевой жидкостью. Обратимые комплексы не утрачивают терапевтической активности и часто имеют положительное значение, так как, постепенно диссоциируя, обеспечивают пролонгированный эффект. В недиссоциированных связях антибиотики полностью инактивируются и могут проявлять токсическое влияние на организм или вызывать аллергию.
Антимикробное действие антибиотиков определяется также локализацией микроорганизмов. При внутриклеточном их расположении антимикробный эффект антибиотиков ничтожно мал. Это объясняется плохой диффузией антибиотиков через оболочку фагоцита и биологическую мембрану фагосомы. Внутри фагоцита и особенно в фагосоме, где снижены содержание кислорода и рН среды, активность антибиотиков резко падает, а аминогликозиды, наделенные основными свойствами, полностью инактивируются. При оценке этиотропного действия антибиотиков in vivo надо также учитывать, что у бактерий, находящихся внутри клеток, понижен метаболизм, и поэтому они обладают «физиологической устойчивостью». Такой механизм лекарственной резистентности, в частности, присущ всем персистирующим бактериям.
Наконец, терапевтическая эффективность антибиотиков зависит от степени чувствительности к ним патогенных бактерий, которая определяется их видовыми особенностями, в частности проницаемостью клеточной стенки, мутационной способностью, наличием у них хромосомных генов резистентности и R-плазмид. Так, клеточная оболочка грамотрицательных бактерий для большинства антибиотиков менее проницаемая, чем у грамположи-тельных, особенно когда они проявляют выраженную гидрофильность (тетрациклины, аминогликозиды, макролиды). В такой же мере проницаемы для антибиотиков S- и й-формы бактерий, отличающиеся тем, что у первых содержится большое количество липополисахаридов, а вторые - в процессе модификации или мутации утрачивают значительную их часть. Проникновение ряда антибиотиков может также зависеть от переноса электрона к атому кислорода, вследствие чего аминогликозиды, например, малоэффективны в отношении анаэробов. Отдельные виды патогенных бактерий снижают активность антибиотиков посредством связывания их с муреингидролазами. Кодируемые хромосомными генами ферменты бактерий инактивируют антибиотики. В частности, Р-лактамазы, продуцируемые стафилококками и грамотрицательными бактериями, разрушают р-лактамные кольца в молекулах пенициллинов и цефалоспоринов, а R-плазмиды, обеспечивающие множественную лекарственную устойчивость бактерий, кодируют синтез ферментов, модифицирующих другие группы антибиотиков (см. «Плазмиды»). Вышеприведенное диктует необходимость в определении антибиотикочувствительности патогенных бактерий, выделенных из патологических материалов, для выбора наиболее эффективного способа лечения инфекционных больных.
Методы определения лекарственной чувствительности бактерий
Испытание на чувствительность бактерий к антибиотикам проводят, используя серийные разведения препаратов в жидких и плотных питательных средах и методы их диффузии в агаровые среды. При этом определяют минимальную ингибирующую (бактериостатическую) концентрацию (МИК) и минимальную бактерицидную концентрацию (МБК) лекарственных веществ.
Методы серийных разведений антибиотиков в мясопептонном бульоне и мясопептонном агаре.
Метод разведений в МПБ (табл. 3). В ряд пробирок, кроме первой, наливают по 0, 5 мл бульона. В первую и вторую вносят 0, 5 мл раствора антибиотика, содержащего 50 ЕД. Разведенный в 2 раза антибиотик из второй пробирки в количестве 0, 5 мл переносят в третью и таким же «перекатом» - во все последующие, а из последней - лишние 0, 5 мл удаляют. Сделав двукратные разведения антибиотика, бульоны засевают 1, 5 мл разведенной 1: 1000 бульонной культуры испытуемого штамма бактерий. Посевы помещают в термостат при температуре 37 °С и через 10-18 ч учитывают МИК и МБК, т. е. наименьшую концентрацию препарата, вызвавшую полную задержку роста бактерий, и такую же его концентрацию, которая привела к их гибели.
| Ингредиенты | Номера пробирок | |||||||||
| Контроль | ||||||||||
| МПБ | - | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 |
| **» | -* | —V | -* | ** | —► | |||||
| 50 ЕД анти- | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 5 | 0, 54 | - |
| биотика | ||||||||||
| Бульонная | 1, 5 | 1, 5 | 1, 5 | 1, 5 | 1, 5 | 1, 5 | 1, 5 | 1, 5 | 1, 5 | 1, 5 |
| культура, | ||||||||||
| 1: 1000 | ||||||||||
| Разведение | 12, 5 | 6, 25 | 3, 12 | 1, 56 | 0, 78 | 0, 39 | 0, 19 | 0, 10 | - | |
| антибио- | ||||||||||
| тика, мкг |
Метод разведений в МПА. Подготовив по 1 мл двойных разведений препарата от 1: 10 000 до 1: 320 000, поочередно вносят их в 9 мл расплавленного и охлажденного до 45-50 °С питательного агара и, быстро смешав, выливают в чашку Петри. После застывания агара дно чашки делят на сегменты, которые засевают испытуемыми видами (штаммами) бактерий, а один из них - культурой с известной антибиоти-кочувствительностью. Одновременно ими можно засевать контрольную чашку Петри без препарата. Среды помещают в термостат при температуре 37 С на 18-20 ч и затем определяют бактериостатическую концентрацию препарата.
Методы диффузии антибиотиков в агаровые среды
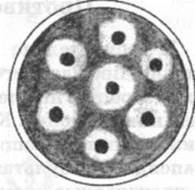
Классический метод диффузии. Свежеприготовленная и подсушенная в течение 20 мин при 37 °С среда засевается равномерным слоем свежевыросшей культуры. После ее впитывания пробойником или горлышком агглютина-ционной пробирки в ней делают лунки, в которые вносят по 0, 1 мл раствора испытуемых антимикробных препаратов и чашку, не переворачивая вверх дном, осторожно переносят в термостат. Спустя 18 ч определяют активность антибиотиков по диаметру зон подавления роста тест-микроба вокруг тех лунок, в которых они содержались.
Метод диффузии препаратов из бумажных дисков. Свежевыросшую исследуемую культуру бактерий (2 млрд м. т./мл) газоном высевают на питательный агар в чашках Петри, избыток отсасывают пастеровской пипеткой. Среду подсушивают и на ее поверхность стерильным пинцетом на расстоянии 2 см друг от друга накладывают стандартные бумажные диски, пропитанные различными антимикробными препаратами. Результаты учитывают после 16-18 ч выращивания при температуре 37 °С, измеряя диаметры зон задержки роста бактерий вокруг бумажных дисков. Сравнивая их величины с прилагаемыми к дискам инструктивными указаниями, определяют, к каким препаратам тест-микроб чувствительный, умеренно чувствительный и резистентный, т. е. может расти даже у края дисков (рис. 52).
Комбинированная антибиотикотерапия. Сочетанное
применение антибиотиков преследует решение двух основных целей - усиление этиотропного действия при одновременном снижении токсического влияния
препаратов на больной организм. При этом комбинации бактерицидных антибиотиков-синергистов и бактериостатиков, обладающих аддитивным (дополнительным) действием, позволяют повысить антимикробную эффективность каждого из них, расширить спектр действия и предотвратить развитие лекарственно-устойчивых популяций микробов.
|
Рис. 52. Зоны торможения роста бактериальной культуры вокруг бумажных дисков, пропитанных антибиотиками
Антагонизм проявляется лишь в сочетаниях бактерицидных антибиотиков с бактериостатиками, ввиду того, что последние, угнетая обмен веществ микробной клетки, снижают ее чувствительность по отношению к первым.
Побочное действие антибиотиков. Различают прямое и косвенное побочное действие антибиотиков. Прямое побочное действие обусловлено органотропностью антибиотиков и выражается в структурных и функциональных изменениях со стороны различных органов и тканей. Так, некоторые из них неблагоприятно влияют на нервную систему, слуховой аппарат, почки, вызывают хромосомные аберрации в соматических и половых клетках. Многие люди отличаются повышенной чувствительностью к антибиотикам и реагируют на их введение крапивницей, отеком слизистых и кожных покровов, другими аллергическими реакциями, а иногда - анафилактическим шоком. Косвенное побочное действие, связанное с паразитотроп-ностью препаратов, проявляется подавлением иммунного ответа на антиген, что ведет к формированию малонапряженного иммунитета, не обеспечивающего устойчивости к реинфекции. Длительное применение антибиотиков приводит к образованию в организме больного лекарственно-резистентных, антибиотикозависимых и атипичных форм микробов, что затрудняет бактериологическое подтверждение диагноза и процесс лечения. Самым неблагоприятным косвенным побочным действием считается дисбактериоз как следствие ингибирования антимикробным препаратом нормальной микрофлоры.
Противовирусные препараты
К избирательно действующим на вирусы веществам можно, прежде всего, отнести препараты, ингибирующие их адсорбцию на клетках, процессы проникновения и раздевания вирионов. К ним, в частности, относятся дизоксарил, препятствующий высвобождению вирусных нуклеокапсидов в результате взаимодействия с суперкапсидами, и производные адамантана ремантадин и амантадин, ингибирующие репродукцию вирусов кори, краснухи, везикулярного стоматита, вирус гриппа, особенно - типа А.
Более широко используются аналоги нуклеотидов (аномальные нуклеозиды), сходные с пуриновыми и пиримидиновыми основаниями. Среди них чаще всего применяют йодоксиуридин и трифторидин (пиримидиновые аналоги) и цитозинарабинозид, ациклогуанозин (ацикло-вир), ганцикловир, фамцикловир, видарабин (пуриновые аналоги), ингибирующие ДНК-полимеразы вирусов. Особое место среди аномальных нуклеозидов занимает аналог гуанозина рибавирин, отличающийся от других тем, что обладает универсальной способностью подавлять как ДНК-, так и РНК-полимеразы вирусов.
Близкими к аномальным нуклеозидам по конечному эффекту антивирусного действия являются производные тиосемикарбазонов, в особенности М1-метилизатин-(3-тио-семикарбазон (метисазон), который ингибирует синтез поздних иРНК, что нарушает сборку дочерних популяций поксвирусов, а также саквинавир, ритонавир, индинавир и другие синтетические пептиды, которые конкурентно подавляют протеазы вирусов. В инфицированных ими клетках постепенно накапливаются нерасщепленные предшественники яад-полипротеина, проявляющие цито-токсическое действие. Угнетают вирусы также антифолиевые препараты (аминоптерин и метатрексат) и виналкалоиды (винкристин и винбластин).
Ведутся поиски ингибиторов обратной транскриптазы. К такого рода препаратам относятся зидовудин (азидотимидин) и его аналоги залцитабин, ставудин, диданазин, встраивающиеся вместо тимина в нуклеотидную цепь гена, контролирующего образование обратной транскриптазы. Синтезированы также препараты, обладающие способностью ингибировать обратную транскриптазу и ДНК-полимеразу. К ним, в частности, относится фоскарнет.
Примечание. Противогрибковые и антипротозойные препараты представлены в соответствующих главах раздела «Частная микробиология».
Микробиология внутрибольничных инфекций.
1) Определение внутрибольничных инфекций (ВБИ).
2) Значение проблемы, основные причины развития ВБИ, эпидемиология. Возбудители госпитальных инфекций.
3) Микрофлора лекарственных средств.
4) Источники загрязнения.
5) Пути повышения микробной чистоты нестерильных лекарственных средств.
6) Действие физических, химических и биологических факторов на микроорганизмы.
Как внутрибольничные, или госпитальные, инфекции (ВБИ) следует рассматривать любые клинические распознаваемые инфекционные заболевания, возникающие у больных после лечебного учреждения с целью лечения, а также у мед персонала в силу осуществляемой им деятельности, независимо от того, проявляются или не проявляются симптомы этого заболевания во время нахождения данных лиц в мед учреждении. Заболевания, связанные с оказанием мед помощи, также обозначают термином ятрогения (от греч. iats, врач) или нозокомиальные (от греч. nosokomeion, больница) инфекции.
В последние десятилетия ВБИ становятся все более значимой проблемой здравоохранения, в экономически развитых странах они возникают у 5 - 10% пациентов, что значительно отягощает течение основного заболевания, создавая угрозу для жизни больного, а также увеличивает стоимость лечения. Во многом это связано с демографическими сдвигами (увеличение числа лиц преклонного возраста) и накопление в популяции лиц повышенного риска (люди с хроническими заболеваниями, интоксикациями или принимающие иммунодепрессанты).
Основные причины развития ВБИ:
• Формирование и селекция «госпитальных штаммов» микроорганизмов, обладающих высокой вирулентностью и множественной лекарственной устойчивостью.
• Нерациональное проведение антимикробной химеотерапни н отсутствие контроля за циркуляцией штаммов с лекарственной устойчивостью.
• Значительная частота носительства патогенной микрофлоры (например, золотистого стафилококка) среди мед персонала (достигает 40%).
Создание крупных больничных комплексов со своей специфической экологией -скученностью в стационарах и поликлиниках, особенностями основного контингента
• (преимущественно ослабленные пациенты), относительной замкнутостью помещений (палаты, процедурные кабинеты и т.д).
• Нарушения правил асептики и антисептики, отклонения от санитарно-гигиенических норм для стационаров и поликлиник.
Эпидемиология.
ВБИ регистрируют повсеместно, в виде вспышек или спорадических случаев. Практически любой пациент стационара предрасположен к развитию инфекционных процессов. ВБИ характеризуют высокая контагенозность, широкий спектр возбудителей и разнообразные пути их передачи: возможность вспышек в любое время года, наличие пациентов с повышенным риском заболевания и возможность рецидивов. Особенности эпидемического процесса зависят от свойства возбудителя, типа учреждения, контингента больных, качества организации мед помощи, санитарно-гигиенического и противоэпидемического режимов. Необходимо отметить значительное обсеменение объектов окружающей среды вследствие активной циркуляции «госпитальных» штаммов условно-патогенной микрофлоры между больными и персоналом, способствующие формированию нового контингента носителей. Иначе говоря, происходит «естественные кругооборот» условно-патогенной микрофлоры по схеме «мед персонал (больные) –» внешняя среда -» мед персонал (больные)», поддерживающий постоянный эпидемический процесс в ЛПУ. Не меньшее значение имеют мед манипуляции и их характер. Часто ВБИ возникают после оперативных вмешательств и инвазивных лечебных и диагностических процедур (например, катетеризация вен и мочевого пузыря) определенный «вклад» вносит новая медицинская аппаратура, требующая особых методов стерилизации.
• Как правило, ВБИ возникают на фоне основного заболевания либо, реже, первично развиваются у новорожденных.
• ВБИ может вызвать практически любой патогенный или условно-патогенный микроорганизм.
• Возбудители ВБИ могут представить воздушно-капельным, воздушно-пылевым, алиментарным путями, трансфузионно, трансплацентарно, при прохождении плода по родовым путям, половым и другим способами.
Возбудители госпитальных инфекций.
Спектр возбудителей ВБИ охватывает вирусы, бактерии, грибы и простейших, представленных наиболее вирулентными «госпитальными» штаммами. Ежегодно их число. Увеличивается, преимущественно за счет условно-патогенных микроорганизмов. Основные возбудители бактериальных инфекций - стафилококки, пневмококки, грамотрицательные энтеробактерии, псевдомонады и анаэробы. Ведущую роль играют стафилококки (до 60% всех случаев ВБИ), грамотрицательные бактерии, респираторные и грибы рода Candida.
• Штаммы бактерий, выделенные от пациентов с нозокомиальными инфекциями, как правило, более вирулентны
обладают множественной химиорезистентностью. Широкое использование антибиотиков с лечебной и профилактической целями лишь частично подавляет рост устойчивых бактерий и приводит к селекции устойчивых штаммов. Происходит формирование «порочного круга» - возникающие ВБИ требуют применение высокоактивных антибиотиков, способствующих в свою очередь появлению более устойчивых микроорганизмов. Не менее важным фактором следует считать развитие дисбактериозов, возникающих на фоне антнбиотикотерапии и приводящих к колонизации органов и тканей условно-патогенными микроорганизмами.
• Факторы, предрасполагающие к развитию инфекций, многообразны.
|