
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
II Безреагентные
|
|
I Реагентные
а) обработка воды различными окислителями – Cl, О3, KMnO4, J2, диоксид хлора (СlO2);
б) введение в воду различных металлов типа серебра, меди и др.
II Безреагентные
а) обработка воды ультрафиолетовыми лучами;
б) ультразвуком, радиоактивным излучением;
в) термическая обработка.
Наибольшее распространение получили такие методы обеззараживания, как:
а) хлорирование;
б) ультрафиолетовое облучение;
в) озонирование воды.
Частично обеззараживание воды достигается и при осуществлении процесса коагулирования воды.
Иногда проводят, если это требуется, дезодорацию воды – т.е. удаляют нежелательные привкусы и запахи воды.
Дезодорацию осуществляют, используя процесс аэрации, а также могут быть применены сорбенты (активированный уголь) и окислители.
Химизм процесса хлорирования воды
При введении хлора в воду образуются хлорноватистая и соляные кислоты:
Cl2 + H2O = HCl + HOCl
далее HOCl диссоциирует
HOCL → ← H+ + OCl-
Сумму Сl2 + HOCl + OCl - называют свободным активным хлором.
↓
И именно эти молекулы и ионы обладают бактерицидным действием
При наличии в воде аммонийных соединений образуются монохлорамины NH2Cl и дихлорамины NHCl2, которые оказывают бактерицидное действие несколько меньше, чем свободный хлор, но более продолжительное.
Хлор в виде хлораминов называют связанным активным хлором.
Правильное назначение дозы хлора является исключительно важным, так как при недостатке активного хлора - нет бактерицидного эффекта, а при его избытке ухудшаются вкусовые свойства воды вследствие появления хлорных, хлорфенольных привкусов и запахов.
Показателем достаточности принятой дозы хлора служит остаточный хлор – согласно нормативным документам Схл.ост = 0, 3-0, 5 мг/л
Расчётную дозу хлора обычно определяют пробным хлорированием при проведении технологического анализа воды.
Хлорирование осветлённой воды производят перед её поступлением в резервуар чистой воды (РЧВ), где обеспечивается хорошее смешение Cl и Н2О и необходимое время контакта ≈ 30 мин. Всё это относится к окончательному хлорированию (обеззараживанию) воды.
В ряде случаев применяют предварительное хлорирование. Предварительное хлорирование предназначено для:
1. уменьшения цветности и окисляемости воды, вследствие разрушения органических веществ в процессе хлорирования;
2. снижения дозы коагулянта за счет устранения тормозящего действия органических веществ, удаляемых на стадии предварительного хлорирования;
3. улучшения санитарного состояние очистных сооружений.
Хлорирование хлорной известью
В ряде случаев на станциях небольшой производительности для обеззараживания воды применяют хлорную известь. Хлорная известь приготавливается путём соединения газообразного хлора с гашёной известью. Обычно она содержит 25-30% активного вещества.
Формула хлорной извести: CaOCl2.
В воде происходит диссоциация хлорной извести:
2CaOCl2 = Ca(OCl)2 + CaCl2,
т.е хлорная известь распадается на гипохлорид Са и СаС12. Далее происходит взаимодействие с находящейся в воде СО2 и Са(НСО3)2:
Са(ОС1)2 + СО2 + Н2О = СаСО 3 + 2НОС1
↓
Также есть вероятность прохождения такай реакции:
Са(ОС1)2 + Са(НСО3)2 =2 СаСО 3 + 2НОС1
↓
В обоих случаях получается НОС1 и далее хлорирование идёт по обычному механизму, рассмотренному ранее.
Ряд специалистов считают, что обеззараживание хлорной известью происходит согласно следующей реакции:
2СаОС12 + 2Н2О → ← СаС12 + Са(ОН)2 + 2НС1О
И далее процесс хлорирования происходит уже по известному механизму.
Хлорирование с аммонизацией
Обеззараживание воды хлорированием с аммонизацией применяют в двухслучаях:
1. для снижения запаха воды;
2. для консервации остаточной концентрации хлора на более длительный период.
Если вода содержит фенолы, бензолы или другие органические соединения (которые могут попасть в источник водоснабжения при сбросе сточных вод), соединения, которых с хлором (хлоропроизводные) ухудшают органолептические свойства воды, то в этом случае аммонизацию проводят до вводахлора. Это связанно с тем, что при последующем введении С1 он болееэнергично взаимодействует с аммиаком, а не с фенолами или бензолом, что предотвращает появление неприятных хлорфенольных запахов.
При этом идут реакции:
NH4OH + HOCl = NH2C1 + 2H2O
NH4OH + 2HOCl = NHC12 + 3H2O
Для снижения хлорных запахов аммиак вводят после хлорирования.
При осуществлении процесса хлорирования с аммонизацией соотношение доз аммиака и хлора устанавливается в лаборатории проведением процесса пробного хлорирования и аммонизации.
Контакт воды с хлором при проведении совместной обработке воды хлороа и аммонием должен быть не менее 1 часа.
Аммиак доставляется на станцию, также как и хлор, в баллонах.
Хлорирование с аммонизацией предотвращает зарастание труб железистыми бактериями, которые могут развиваться в трубах и должно проводиться при рН > 7 т.к. при меньших значениях рН образование хлораминов происходит медленно.
Электролитический способ получения NaOC1
В связи с тем, что не всегда представляется целесообразным использовать газообразный С1 – в ряде случаев его получают на месте его потребления электролитическим способом. При этом отпадают такие трудности при осуществлении хлорирования газообразным хлором, как:
1. сложность транспортирования, поскольку может быть значительная удалённость заводов - поставщиков хлора от очистных станций;
2. сложность хранения на складах отравляющего газа, каковым является Сl, и возникает опасность отравления людей в населённых пунктах, которые находятся вблизи.
Электролизная установка состоит из бака для растворения соли, и. собственно, электролизёра. Электролизёр представляет собой аппарат, выполненный из нержавеющей стали, с графитовым анодом и катодом. В баке готовится раствор NaС1 с концентрацией 280-300 г/л, и затем этот раствор перекачивается в электролизёр. В электролизёре его разбавляют водой до концентрации 100-120 г/л.
Под действием постоянного электрического тока в электролизёре идут следующие реакции:
на аноде:
2С1- → ← С12↑ +2е,
на катоде:
2Н2О + 2е → ← 2ОН- + Н2↑
Выделяющийся хлор растворяется в электролите с образованием:
С12 +Н2О → ← НОС1 + НС1
И после нейтрализации этого раствора NaОН получается гипохлорит Na:
НОС1 + NaОН = NaОС1 + Н2О
Насыщенный раствор NaОС1 сливают в бак накопитель и подают в обрабатываемую воду.
Следует учитывать, что при длительном хранении NaОС1 теряет свою активность.
Перехлорирование (П-е) и дехлорирование (Д-е)
При перехлорировании применяют дозу хлора 5-10 мг/л и более.
В каких случаях применяют П-е:
1. в аварийном случае, когда вода из источника водоснабжения подаётся в обход всей водоочистной станции в РЧВ;
2. когда качество воды в источнике подвержено резким и быстрым колебаниям – при этом если воду хлорировать обычным методом, то не достигается нужный эффект обеззараживания;
3. П-е также применяют как меру борьбы с высокой цветностью воды, запахами и привкусами.
При перехлорировании остаточные дозы хлора в обработанной воде велики. Поэтому необходимо осуществлять удаление избыточной части активного хлора, т.е. проводить дехлорирование воды.
Для этого в обработанную воду вводят вещества, способные связывать избыточный хлор:
Поскольку хлор является окислителем, то в качестве таких веществ применяют вещества - восстановители типа:
· гипосульфата Na или серноватистокислого натрия - Na2S2O3;
· сульфита натрия - Na2SO3;
· cернистого газа - SO2.
При использовании гипосульфита Na происходит следующая реакция взаимодействия с хлором:
Na2S2O3 + 4С12 + 5Н2О = Na2SO4 + H2SO4 + 8HCl
Гипосульфит вводят в воду в виде 1-1, 5% раствора.
Недостаток данного метода: Na2S2O3 может быть бактериально загрязнён, т.е. не исключена возможность повторного загрязнения воды болезнетворными бактериями.
Кроме Na2S2O3 для Д-е воды может быть применён сернистый газ SO2. Идёт следующая реакция:
SO2 + 2H2O + Cl2 = H2SO4 + 2HCl
При этом SO2 является химически чистым реагентом и здесь исключена возможность повторного загрязнения. Поскольку продуктами данной реакции является серная и соляная кислоты, то может иметь место уменьшение щелочности обрабатываемой воды и снижение рН. А удаление хлора происходит практически полностью из обрабатываемой воды.
И третий способ дехлорирования воды осуществляют за счет применения угольных фильтров.
В качестве загрузки в угольных фильтрах используют активированный уголь различных марок. Активированный уголь имеет большую пористость, широко развитую поверхность и задержание хлора происходит в угольных фильтрах весьма эффективно.
Высоту слоя угля применяют 2, 5 м, скорость фильтрования 20-30 м/час, диаметр зёрен 1, 5-2, 5 мм.
Регенерацию угольного фильтра от органических веществ проводят горячим раствором соды ~ 1 раз в месяц, а 1-2 раза в год требуется прокалка угля в специальных печах.
Итак, преимущества метода хлорирования:
1. надёжен, обладает пролонгированным (длительным) действием;
Недостатки метода:
1. большое реагентное хозяйство;
2. необходимость перехлорирования при низком качестве исходной воды;
3. коррозия трубопроводов из-за хлора вследствие уменьшения величины рН;
4. привозной гипохлорид при хранении значительно теряет свою активность, что затрудняет дозирование;
5. сильное раздражающее воздействии не слизистую оболочку человека.
6. образование в обеззараживаемой воде канцерогенных и мутагенных хлорпроизводных типа хлороформа, 4-х хлористого углерода и др.
Озонирование воды
Основано на применении озона, О3.
Озон легко разлагается:
О3 → О2 + О
на атомарный кослород - О и молекулярный - О2. Именно атомарный кислород является наиболее сильным окислителем. Он способен разрушать компоненты цветности воды, бактерии, вирусы и т.д.
Данное свойство озона позволяет с помощью озонирования производить не только обеззараживание воды, но и ее обесцвечивание и дезодорацию (уничтожение запахов и привкусов).
Причём О3 не ухудшает природных свойств воды, а в случае если в обрабатываемой воде будет избыток О3, вкусовые качества воды не изменятся (в отличие от хлорирования).
Однако, следует иметь в виду, что О3 является токсичным веществом.
ПДК О3 в воздухе помещений, где находятся люди, составляет 0, 1 мг/м3. В связи с этим в помещениях озонарных установок должны быть приняты все меры для того, чтоб озон не попал в помещение, где работают обслуживающие установку сотрудники.
Недостатки метода озонирования:
1. достаточно сложное и дорогостоящее оборудование, требующее специального блока подготовки воздуха;
2. для смешения Н2О + О3 требуются контактные камеры (борботаж. колоны высотой 3-5 м), а при непосредственном вводе О3 в тр-ды КПД ~ 10%;
3. оборудование требует специального помещения с системой вытяжной вентиляции ввиду низкого значения ПДК озона в воздухе (0, 1 мг/м3);
4. Из-за коррозии все коммуникации и оборудование должны быть озоностойкими.
Контроль процесса обеззараживания воды хлорированием
Как указывалось выше, при введении газообразного хлора в воду происходит его растворение в воде с образованием хлорноватистой и соляной кислоты:
С12 + Н2О → ← НОС1 + НС1
Далее НОС1 диссоциирует на ионы:
НОС1 → ← Н+ + ОС1-
Считается, что наибольшим бактерицидным действием обладают молекулы недиссоциированной НОС1. И поэтому обеззараживание будет наиболее эффективным в условиях, при которых диссоциация НОС1 будет подавлена.
Такие условия обеспечиваются в слабокислотной или нейтральной среде.
Механизм бактерицидного действия НОС1 объясняется диффузией молекул НОС1 внутрь клетки и её окислением. Причём, процессы диффузии и окисления не протекают мгновенно и условием эффективного обеззараживания является интенсивное и полное смешивание обрабатываемое воды с хлором и длительный контакт с водой.
Причём, разные воды обладают разной хлоропоглащаемостью. Хлоропоглащаемость зависит от количества и характера примесей воды, способных окисляться С12.
Для обеспечения необходимого бактерицидного эффекта требуется вводить вводу некоторый избыток С12 по сравнению с хлоропоглащаемостью воды, так чтоб в воде оставался остаточный хлор.
УПРАЖНЕНИЕ.
Автоматический прибор, контролирующий остаточный хлор в воде, зафиксировал его падение. Дежурный оператор увеличил дозу хлора, но величина остаточного хлора продолжала уменьшаться. Чем это объяснить?
РЕШЕНИЕ.
Такое явление может быть объяснено появлением в воде солей аммония.
В этом случае хлор связывает аммонийные соли в хлорамин. Это соединение типа:
NH2Cl – монохлорамин
NHCl2 – дихлорамин
Если доза хлора оказалась большей, чем необходимо для связывания всего аммиака, начинается процесс окисления хлораминов. При этом повышение дозы хлора в некотором интервале будет сопровождаться уменьшением остаточного связанного хлора вследствие окисления хлораминов.
Когда отношение молярных концентраций хлора и аммонийных солей, содержащихся в обрабатываемой воде, станет равным 2, то все хлорамины будут окислены и дальнейшее увеличение дозы приведёт к повышению концентрации свободного остаточного хлора, что показано на графике:
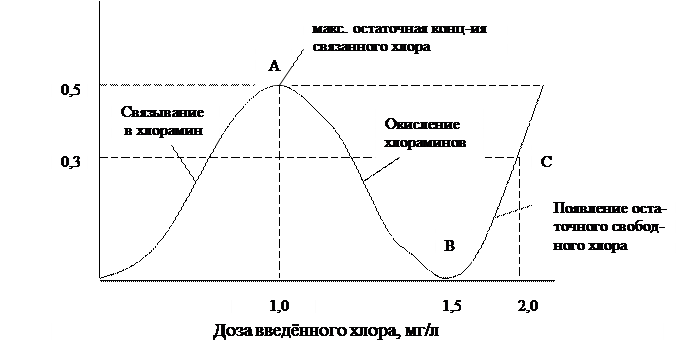
В точке В хлорамины полностью окислены и дальнейшее увеличение дозы приведут к появлению свободного остаточного хлора.
Приняв, что его концентрация должна быть = 0, 3 мг/л проводим прямую, параллельную оси абсцисс, до пересечения с участком кривой ВС.
Опустив перпендикуляр из точки пересечения на ось абсцисс, получим эффективную бактерицидную дозу хлора – 2 мг/л.
|