
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Альвеолярного дыхания
|
|
Как известно, газообмен в легких происходит благодаря диффузии газов через альвеолярно-капиллярную мембрану по градиенту концентрации О2 и СО2. Объемная скорость диффузии определяется по формуле:
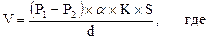
(Р1 − Р2) — трансмембранный градиент парциального давления газа, равный в начальном отрезке капилляра для О2 60 мм рт. ст. (в альвеолярном воздухе давление О2 (Р1) равно 106 мм рт. ст., в легочных капиллярах (Р2) — 46 мм рт. ст.), для СО2 6 мм рт. ст. (в альвеолярном воздухе давление СО2 (Р1) равно 46 мм рт. ст., в легочных капиллярах (Р2) — 40 мм рт. ст.). Эти градиенты давлений служат движущей силой диффузии О2 и СО2, т.е. газообмена в легких.
 a — растворимость газов в тканях. Следует заметить, что поскольку растворимость СО2 в мембране примерно в 20 раз больше, чем О2, то и скорость диффузии СО2 через альвеолярно-капиллярную мембрану в 20 раз выше;
a — растворимость газов в тканях. Следует заметить, что поскольку растворимость СО2 в мембране примерно в 20 раз больше, чем О2, то и скорость диффузии СО2 через альвеолярно-капиллярную мембрану в 20 раз выше;
К — константа диффузии;
S — площадь альвеол (или площадь газообмена, которая составляет 50–100 м2);
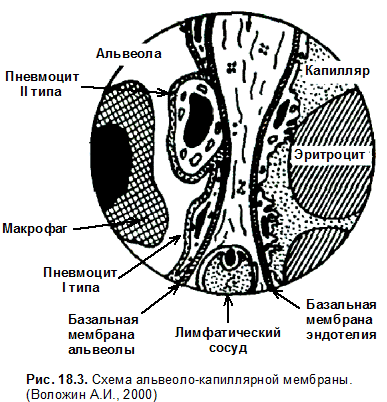
d — это толщина альвеолярно-капиллярной мембраны, которая препятствует диффузии газов. В организме здорового человека толщина альвеолярно-капиллярной мембраны варьирует от 0, 3 до 2 мкм.
Изнутри альвеолы выстланы сурфактантом. Сурфактант — это поверхностно-активное вещество (ПАВ), выстилающее альвеолы, продуцируется альвеолоцитами второго порядка и на 70–80 % состоит из фосфолипидов (фосфатидилхолин, фосфатидилглицерол, дипальмитоилфосфатидилхолин и т.д.), а на 20–30 % — из белков (апопротеины, сывороточные альбумины). В условиях нормы постоянно происходит обновление сурфактанта за счет фагоцитоза альвеолярными макрофагами и его синтеза альвеолоцитами 2‑ го типа. Сурфактант выполняет следующие функции: снижает поверхностное натяжение альвеол и обеспечивает их стабилизацию, предупреждает спадение альвеол, обеспечивает несмачиваемость при вдохе, улучшает диффузию газов, увеличивает растяжимость легких, препятствует пенообразованию. В регуляции секреции сурфактанта участвуют различные гормоны, в частности катехоламины, эстрогены, тироксин, глюкокортикоиды, которые усиливают выработку сурфактанта. В тоже время инсулин, андрогены, а также атропин, белки и липиды сурфактанта — угнетают его синтез. Уменьшение выработки сурфактанта наблюдается при гиповентиляции, хронической гипоксии, легочной гипертензии, при поражении альвеолоцитов II типа, при вдыхании табачного дыма и чистого кислорода и т.д. При этом нарушается диффузия газов, развиваются ателектазы и отек легких, образуется пена.
Недостаток внутрилегочного сурфактанта служит первопричиной развития респираторного дистресс-синдрома новорожденных у недоношенных детей. Своеобразие патологии дыхательной системы у детей раннего возраста может быть обусловлено особенностями ее строения и функции. Наличие узких носовых ходов, а также длинных, узких и малоразветвленных бронхов, обилие межуточной ткани, кровеносных и лимфатических сосудов в легких способствуют возникновению разнообразных пневмопатий, которые лежат в основе синдрома дыхательных расстройств (СДР) у значительного числа новорожденных.
Наиболее частой и тяжелой формой пневмопатий являются гиалиновые мембраны, особенно у недоношенных детей, развивающихся в условиях патологического течения беременности и родов. В образовании гиалиновых мембран, состоящих из фибрина, сывороточных протеинов и клеточных элементов, патогенетическую роль играет недостаточность фибринолитической системы. К нарушению фибринолитических процессов и ретенции фибрина в альвеолах может предрасполагать дефицит плазминогена. Гиалиновые мембраны располагаются в просвете альвеолярных ходов, альвеол, легочных бронхов, лежат как уплотненные массы в просвете свободно или выстилают стенки дыхательных путей, способствуя их обтурации, нарушению легочной вентиляции, развитию гипоксемии, вазоконстрикции сосудов и гипоперфузии легких. В то же время возникают инактивации альвеолярного сурфактанта, ухудшение расправления легочной ткани и развивается обструктивно-рестриктивные формы ДН у детей.
К менее тяжелой разновидности пневмопатий относится отечно-геморрагический синдром. В легких отмечается резкое усиление кровенаполнения сосудов всех калибров, особенно капилляров. Просвет альвеолярных ходов и альвеолы заполнены отечной жидкостью и кровью, отечна межуточная ткань. Массивные легочные кровоизлияния могут быть обусловлены синдромом ДВС, развивающимся при асфиксии или внутриутробном инфицировании плода. В легких формируются ателектазы от сегментарных до тотальных, сочетающиеся с отеком и другими гемодинамическими изменениями, а также признаками незрелости легких. У детей обнаруживаются одышка, хрипы, ослабление дыхания, респираторный или смешанный ацидоз.
Аспирационный синдром развивается чаще у достаточно крупных детей в условиях патологических родов. При массивной аспирации околоплодных вод, мекония, крови аспирационный материал вызывает обструкцию дыхательных путей, повреждает сурфактантную систему легких, нарушает расправление легочной ткани и ее перфузию, что обусловливает возникновение ДН у новорожденных. В первые часы после рождения у детей наблюдаются одышка, приступы тяжелой вторичной асфиксии. Инфицирование аспирационных масс нередко сопровождается развитием бактериальной пневмонии.
Внутриутробная пневмония возникает в условиях внутриутробного инфицирования. ДН выявляется с момента рождения и нарастает в течение недели на фоне явных признаков интоксикации. Очаговые воспалительные инфильтраты сочетаются с ателектазами легких и нарушением в них гемодинамики. Гнойно-некротические очаги пневмонии или участки катарально-гнойного воспаления обнаруживаются на фоне гиалиновых мембран и других форм пневмопатий.
Пороки развития легких могут вызвать развитие острую ДН в первые часы и дни жизни новорожденного. Среди них чаще встречают атрезию хоан, пищеводно-трахеальные свищи, долевую эмфизему, агенезию и гипоплазию легких, поликистоз и диафрагмальную грыжу. Гипоплазия и агенезия характеризуются недоразвитием или отсутствием одного легкого или долей легких. Гипоплазия может быть тотальной и парциальной на уровне деления главных бронхов, сегментарных, субсегментарных и ниже субсегментарных бронхов.
Развитию СДР у новорожденных содействует ишемия легких, обусловленная наличием шунтов и поступлением основного объема крови из правого сердца в левое, минуя легкие. Такое состояние кровотока приводит к замедлению расправления легких, уменьшению образования сурфактанта, вторичному спадению легких с последующим сужением сосудов и проявлением признаков ДН.
Патология беременности, сопровождающаяся внутриутробной гипоксемией и гипоксией плода, приводит обычно к спазму сосудов и нарушению перфузии легких, дефициту сурфактанта и развитию СДР у новорожденных.
СДР у новорожденных может возникать при воздействии внелегочных этиологических факторов. Среди них на первом месте стоит родовая травма ЦНС, сочетающаяся с массивными кровоизлияниями и последующим нарушением функции механического аппарата легочной вентиляции. Возможно сочетание травматических повреждений с развитием пневмопатий, нарушением микроциркуляции и ателектазированием легочной ткани. Пороки развития сердца, диафрагмы и грудной клетки также могут являться причиной нарастающей ДН новорожденных.
Течение СДР может быть острым и подострым. В период восстановления исчезают признаки ДН и нарушения функции ЦНС, нормализуется кровообращение, исчезают отеки. Однако у детей, перенесших СДР, возможно развитие хронической легочной патологии. Развивающаяся бронхолегочная дисплазия связана с незрелостью бронхоальвеолярной системы легких и изменениями, обусловленными гиалиновыми мембранами. К ним относятся бронхиолярный и интерстициальный фиброз, облитерирующюий бронхиолит с интерстициальным некрозом. Возникающая при этом хроническая ДН сопровождается гипоксемией, гиперкапнией и гипоксией разных органов и тканей.
Респираторный дистресс-синдром может возникать и у взрослых. Он был описан Эсбахом в 1967 г. В литературе часто используются синонимы этого синдрома: шоковое легкое, некардиогенный отек легких.
Респираторный дистресс-синдром взрослых (РДСВ) — патологический процесс, характеризующийся артериальной гипоксемией, резистентной к обычным методам кислородотерапии, первичным повреждением альвеолярно-капиллярной мембраны, интерстициальным отеком легких, микроателектазированием и образованием в альвеолах и бронхиолах гиалиновых мембран. Он является завершающей фазой многообразных повреждений легких (кислотами, токсинами бактериального и не бактериального происхождения, метаболитами арахидоновой кислоты, при травме грудной клетки, синдроме длительного сдавления, аутоиммунных заболеваниях и т.д.). РДВС клинически проявляется одышкой, кашлем, с выделением мокроты, имеющей примесь крови, мелкопузырчатыми влажными хрипами в легких, цианозом, не исчезающим даже при оксигенотерапии.
Время развития РДСВ составляет от нескольких часов до 3 суток от начала воздействия этиологического фактора. Различают три патоморфологических фазы РДСВ: острую, подострую и хроническую.
Острая фаза РДСВ длится 2–5 суток и характеризуется развитием интерстициального, а затем альвеолярного отека легких. В отечной жидкости содержатся белок, эритроциты, лейкоциты. Наряду с отеком выявляется поражение легочных капилляров и выраженное повреждение альвеолярного эпителия I и II типов. Повреждение альвеолоцитов II типа приводит к нарушению синтеза сурфактанта, вследствие чего развиваются микроателектазы. При благоприятном течении РДСВ через несколько дней острые явления стихают, отечная жидкость рассасывается. Однако такое благоприятное течение РДСВ наблюдается не всегда. У части больных РДСВ переходит в подострую и хроническую фазы.
Подострая фаза характеризуется интерстициальным и бронхоальвеолярным воспалением.
Хроническая фаза РДСВ — это фаза развития фиброзирующего альвеолита. В альвеолярно-капиллярной базальной мембране разрастается соединительная ткань, мембрана резко утолщается, уплощается. Наблюдается выраженная пролиферация фибробластов и усиленный синтез коллагена (его количество увеличивается в 2–3 раза). Выраженный интерстициальный фиброз может сформироваться уже через 2–3 недели. В хронической фазе наблюдаются также изменения в сосудистом русле легких — запустевание сосудов, развитие микротромбозов. В конечном итоге развиваются хроническая легочная гипертензия и хроническая дыхательная недостаточность.