
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Представление структуры молекул
|
|
Молекулы состоят из атомов, расположение которых в молекуле передаёт структурная формула. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов. Отдельно рассматриваются макромолекулы полимеров.
Молекулы являются объектом изучения теории строения молекул, квантовой химии, аппарат которых активно использует достижения квантовой физики, в том числе релятивистских её разделов.
Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях (например, s – и р – орбитали). Несмотря на это, связи оказываются равноценными и расположены симметрично, что обеспечено гибридизацией атомных орбиталей.
Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов образующиеся электронные пары оказались максимально удалёнными друг от друга. Это сводит к минимуму энергию отталкивания электронов в молекуле.
Гибридизация не является реальным процессом. Это понятие введено для описания геометрической структуры молекулы. Форма частиц, возникающих при образовании ковалентных связей, в которых участвуют гибридные атомные орбитали, зависит от числа и типа этих орбиталей. При этом σ – связи создают жёсткий «скелет» частицы:
| Орбитали участвующие в гибридизации | Тип гибридизации | Пространственная форма молекулы | Примеры |
| s, p | sp – гибридизация

| Линейная

| BeCl2 CO2 C2H2 ZnCl2 BeH2 Две sp - орбитали могут образовывать две σ - связи (BeH2, ZnCl2). Еще две p- связи могут образоваться, если на двух p - орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2). |
| s, p, p | sp2 – гибридизация

| Треугольная (плоская тригональная)

| BH3 BF3 C2H4 AlCl3 Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется σ - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется π - связь. Три sp2- орбитали могут образовывать три σ - связи (BF3, AlCl3). Еще одна связь (π - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4). |
| s, p, p, p | sp3 – гибридизация

| Тетраэдрическая

| СH4 NH4+ PO43- BF4- |
На практике вначале экспериментально устанавливают геометрическую структуру молекулы, после чего описывают тип и форму атомных орбиталей, участвующих в её образовании. Например, пространственная структура молекул аммиака и воды близка к тетраэдрической, но угол между связями в молекуле воды равен 104, 5˚, а в молекуле NH3 – 107, 3˚.
Аммиак NH3
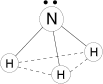
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая sp3 - гибридная орбиталь занята неподеленной электронной парой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+, а также является причиной отклонения от тетраэдрического угла в строении
Вода H2O
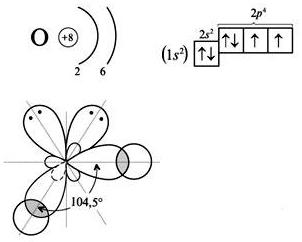
Молекула воды имеет угловое строение: представляет собой равнобедренный треугольник с углом при вершине 104, 5°.
Атом кислорода находится в sp3- гибридном состоянии; из четырех гибридных орбиталей кислорода две участвуют в образовании одинарных связей О–H, а две другие sp3 - гибридные орбитали заняты неподеленными электронными парами, их действие является причиной уменьшения угла от 109, 28˚ до 104, 5°.
7??
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомеры – это вещества, которые имеют одинаковый состав и одинаковую молярную массу, но различное строение молекул, а потому обладающие разными свойствами.
Научное значение теории химического строения:
1) углубляет представления о веществе;
2) указывает путь к познанию внутреннего строения молекул;
3) дает возможность понять накопленные в химии факты; предсказать существование новых веществ и найти пути их синтеза.
Всем этим теория в огромной степени способствовала дальнейшему развитию органической химии и химической промышленности.
Немецкий ученый А. Кекуле высказывал мысль о соединении атомов углерода друг с другом в цепи.
Учение об электронном строении атомов.
Особенности учения об электронном строении атомов: 1) позволило понять природу химической связи атомов; 2) выяснить сущность взаимного влияния атомов.