
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Поддерживать в наиболее высоком положении
|
|
6. После полного разложения перекиси водорода реакционный сосуд охладить до температуры термостата, выдержать в нем в течение 25 – 30 мин. и при равенстве уровней жидкости в бюретке и уравнительном сосуде ещё раз замерить уровень жидкости в бюретке.
7. При обработке экспериментальных данных за начало реакции принимать третье или четвертое измерение, т.е. измерение в условиях установившегося режима.
8. Рассчитать константу скорости реакции по формуле (17), подставив вместо концентраций раствора объемы газа, выделяющегося в реакции:
 ,
,
где  − объем кислорода, выделившейся после разложения всего пероксида водорода (определяется как разность между объемом, определенным после кипячения, и объемом в момент, принятый за начало реакции),
− объем кислорода, выделившейся после разложения всего пероксида водорода (определяется как разность между объемом, определенным после кипячения, и объемом в момент, принятый за начало реакции),  - объем кислорода, выделившийся ко времени прохождения реакции
- объем кислорода, выделившийся ко времени прохождения реакции  .
.
9. По формуле (3) рассчитать среднее значение константы скорость реакции 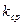 .
.
10. Оценить погрешность результатов определения константы скорости реакции с помощью критерия Стьюдента.
11.Определить константу скорости реакции графически, используя дифференциальную и интегральную форму кинетического уравнения.
12.Сравнить рассчитанное значение  с найденными графически по п. 11 и найти относительную ошибку.
с найденными графически по п. 11 и найти относительную ошибку.
Контрольные вопросы
1. Дать полное определение понятия катализа.
2. Основные представления о механизме каталитической реакции.
3. Кинетические особенности исследуемой реакции.
4. Формы каталитического воздействия на реакционный процесс.
5. Какие механизмы гомогенного катализа вы знаете?
6. Основные положения теории промежуточных соединений.
7. Способы изучения кинетических особенностей каталитических реакций.
8. Способы оценки погрешности экспериментальных результатов.
Работа 7. Исследование кинетики автокаталитической реакции
Цель работы: ознакомление с явлением гомогенного автокатализа и определение кинетических параметров реакции.
В работе изучается явление автокатализа на примере реакции йодирования ацетона  . Рассматриваемая реакция суммарно выражается уравнением
. Рассматриваемая реакция суммарно выражается уравнением 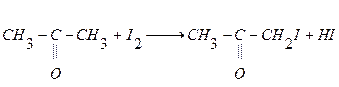 . Для её скорости можно записать выражение:
. Для её скорости можно записать выражение: 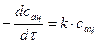 . В разбавленном нейтральном водном растворе рассматриваемая реакция протекает крайне медленно, но процесс каталитически ускоряется кислотами. Так как ионы водорода являются продуктом, то реакцию называют автокаталитической.
. В разбавленном нейтральном водном растворе рассматриваемая реакция протекает крайне медленно, но процесс каталитически ускоряется кислотами. Так как ионы водорода являются продуктом, то реакцию называют автокаталитической.
На самом деле процесс протекает в две стадии:
1 стадия – реакция энолизации ацетона
 ;
;
2 стадия – взаимодействие йода с энольной формой ацетона:
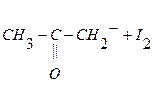
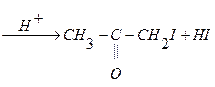 .
.
Первая реакция протекает очень медленно, вторая, наоборот, очень быстро и практически до конца, поэтому константа скорости суммарной реакции определяется по выражению 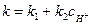 , где
, где 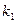 - константа скорости первой реакции;
- константа скорости первой реакции;  - каталитический коэффициент.
- каталитический коэффициент.
Кинетическое уравнение для скорости рассматриваемой реакции в целом можно переписать в виде 

 . Так как реакция 2-ой стадии в отсутствие водорода практически не идет, можно принять, что
. Так как реакция 2-ой стадии в отсутствие водорода практически не идет, можно принять, что 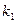 = 0, и тогда выражение для скорости реакции примет вид
= 0, и тогда выражение для скорости реакции примет вид  . В последнем выражении произведение
. В последнем выражении произведение 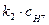 имеет смысл константы скорости автокаталитической реакции
имеет смысл константы скорости автокаталитической реакции
 . (32)
. (32)
Используя понятие убыли вещества 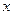 , кинетическое уравнение можно представить в виде
, кинетическое уравнение можно представить в виде
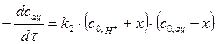 , (33)
, (33)
где 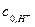 и
и 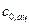 - начальные концентрации ионов водорода и ацетона. Видно, что
- начальные концентрации ионов водорода и ацетона. Видно, что 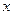 можно представить как увеличение концентрации катализатора.
можно представить как увеличение концентрации катализатора.
Интегральная форма кинетического уравнения реакции имеет вид
 . (34)
. (34)
Приборы и материалы: термостат, термометр, часы, реакционная мерная колба на 250 см3, химический стаканчик на 100 см3, бюретка с колбой для титрования, пипетки: на 25 см3 - 6 шт. Растворы: 0, 05 М  , 1М
, 1М 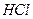 , 1М
, 1М  , 0, 1М
, 0, 1М 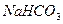 , 0, 0005М
, 0, 0005М  , крахмал.
, крахмал.