
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Простые и кратные углерод-углеродные связи
|
|
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА УГЛЕРОДА
Атом углерода во внешней электронной оболочке имеет 4 атомных орбитали:
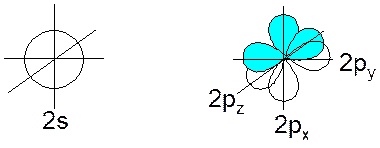
При образовании связей происходит т.н. гибридизация атомных орбиталей: несколько близких по энергии орбиталей как бы усредняются, образуя такое же количество орбиталей равных по энергии и отличающихся геометрической направленностью. Гибридные орбитали обеспечивают более полное перекрывание при образовании связей, и это делает гибридизацию энергетически выгодной.
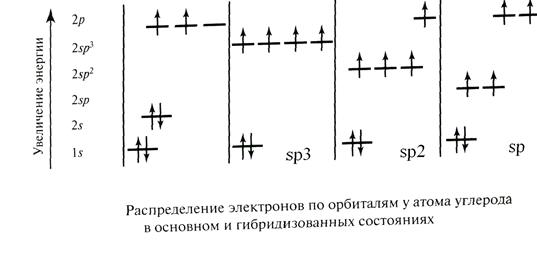
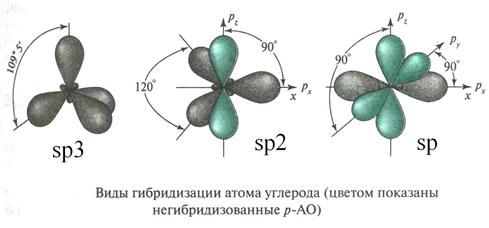
У атома углерода различаются три типа гибридизации:
· sp3 гибридизация, в ней участвует s-орбиталь и три р-орбитали;
· sp2 гибридизация: s-орбиталь и две р-орбитали;
· sp гибридизация: s-орбиталь и одна р-орбиталь.
ПРОСТЫЕ И КРАТНЫЕ УГЛЕРОД-УГЛЕРОДНЫЕ СВЯЗИ
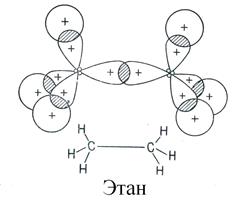
Простая (ординарная) σ -связь образуется путем осевого перекрывания гибридных орбиталей. Молекула этана имеет трехмерную (тригональную) геометрическую структуру:
Двойная связь образуется между двумя sp2-гибридизованными атомами и состоит из σ -связи, образованной осевым перекрыванием гибридных орбиталей, и π -связи, образованной боковым перекрыванием негибридизованных р-орбиталей. Молекула этилена имеет дигональную (планарную) геометрическую структуру - все σ -связи расположены в одной плоскости:
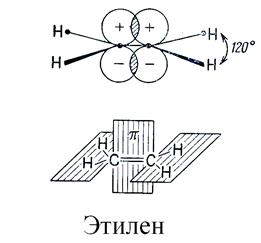
Тройная связь образуется между двумя sp-гибридизованными атомами и состоит из σ -связи и двух π -связей, причем плоскости π -связей перпендикулярны друг другу. Молекула ацетилена имеет линейную геометрическую структуру (все σ -связи находятся на одной прямой):

Длины связей уменьшаются в следующей последовательности:
ординарная > двойная > тройная