
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ДНК-зависимые РНК-полимеразы
|
|
В соответствии с субъединичным составом РНК-полимеразы подразделяются на две группы. К первой группе относятся ферменты, состоящие только из одной субъединицы, среди них – РНК-полимеразы митохондрий и небольших бактериофагов, например SP6 и T7. Эти РНК-полимеразы транскрибируют небольшое число генов простых геномов, и для их функционирования не требуется сложных регуляторных воздействий. Вторую группу составляют сложно устроенные РНК-полимеразы бактерий и эукариот, которые представляют собой многосубъединичные белковые комплексы, транскрибирующие сотни и тысячи различных генов. Такие ферменты во время своего функционирования реагируют на многочисленные регуляторные сигналы, поступающие от регуляторных последовательностей нуклеотидов и белковых факторов. Не исключено, что общепринятое разделение РНК-полимераз по структурно-функциональному признаку является упрощением. Имеются данные, указывающие на то, что и просто устроенные фаговые РНК-полимеразы функционируют in vivo в комплексе с другими белками бактериальных клеток, которые могут существенно изменять их ферментативные свойства.
РНК-полимераза E. coli. Наиболее изученной из бактериальных ферментов является РНК-полимераза E. coli. Она осуществляет транскрипцию всех бактериальных генов. Фермент состоит из пяти субъединиц: b‘- (молекулярная масса 165 кДа), b- (155 кДа), двух a- (35 кДа каждая) и s- (чаще всего 70 кДа (s70)). Комплекс из четырех субъединиц bb‘aa, часто обозначаемый буквой Е (enzyme), образует так называемый минимальный (кор-) фермент E. coli, который способен осуществлять все основные этапы транскрипции, за исключением правильной инициации (см. ниже). Для инициации транскрипции требуется присутствие определенной регуляторной s-субъединицы, необходимой для распознавания РНК-полимеразой промоторов бактериальных генов, определяющей специфичность взаимодействия РНК-полимеразы с промоторами и, возможно, последующую изомеризацию комплекса РНК-полимераза–промотор, необходимую для начала синтеза РНК. Полный фермент, включающий s70-субъединицу, часто называют холоферментом и обозначают Еs70. РНК-полимераза Еs70 способна транскрибировать большинство (но не все) генов E. coli. В частности, для транскрипции генов теплового шока, оперонов gln или nif требуется включение в состав полного фермента другой регуляторной субъединицы – s54 (молекулярная масса 54 кДа) вместо s70 с образованием фермента Es54. В настоящее время описано до десяти различных s-факторов, объединение которых с минимальным ферментом дает возможность образующимся холоферментам узнавать разные промоторы. Все четыре субъединицы кор-фермента обеспечивают контакт РНК-полимеразы с промоторами. При этом b‘-субъединица участвует в связывании фермента с ДНК, b-субъединица образует каталитический активный центр, а a-субъединицы обеспечивают правильное взаимодействие фермента с промоторами. Утверждения, заключенные в двух последних предложениях, нужно воспринимать с известной долей скепсиса. Данные такого рода обычно получают с использованием ферментов, у которых под действием мутаций изменены конкретные субъединицы, и если, например, мутация в гене a-субъединицы нарушает связывание РНК-полимеразы с ДНК, делаются соответствующие выводы. Такая методология (впрочем, одна из самых плодотворных среди существующих), к сожалению, напоминает известный способ локализации органа слуха у тараканов путем обрывания ног – поскольку тараканы без ног не реагируют на звуки убеганием, делается вывод, что они воспринимают звуковые сигналы ногами. Любая мутантная субъединица в составе олигомерного фермента может изменять его общую конформацию и придавать ферменту самые неожиданные свойства. Более прямым методом определения мест контакта макромолекул при белок–белковых и белково–нуклеиновых взаимодействиях является метод поперечных сшивок с использованием бифункциональных химических агентов. Такие химические соединения образуют ковалентные связи (поперечные сшивки) между близкорасположенными реакционноспособными группами. Однако сам факт наличия контакта между макромолекулами еще нельзя однозначно интерпретировать в пользу его функциональной значимости.
В отличие от эубактерий, которые, как уже упоминалось выше, при транскрипции различных наборов генов используют разные s-факторы, эукариоты для достижения тех же целей прибегают к другой стратегии – специализации молекул РНК-полимераз. В ядрах эукариот обнаружены по меньшей мере три специализированные формы РНК-полимераз. РНК-полимераза I осуществляет транскрипцию генов рибосомных РНК (рРНК), синтезируя в ядрышках предшественники 18S и 28S рРНК; РНК-полимераза II участвует в образовании мРНК, а РНК-полимераза III транскрибирует гены транспортных (тРНК), 5S и других низкомолекулярных РНК. Каждый из этих ферментов представляет собой многосубъединичный белковый комплекс, состоящий из двух больших (120–220 кДа) и 5–13 малых (10–100 кДа) субъединиц. Несколько малых субъединиц являются общими для разных форм РНК-полимераз. Большие же субъединицы гомологичны своими аминокислотными последовательностями участкам b- и b’-субъединиц эубактерий, что, возможно, отражает фундаментальное сходство в структуре и функционировании активных центров этих ферментов. Более того, аминокислотные последовательности a-субъединиц бактериальных РНК-полимераз, необходимые для их взаимодействия с большими субъединицами минимального фермента, имеют гомологи в третьей по размеру большой субъединице РНК-полимеразы II, а также в субъединице, общей у РНК-полимераз I и III. Несколько небольших субъединиц эукариотических РНК-полимераз, не имеющих аналогов у бактериальных ферментов, являются общими для всех РНК-полимераз, что может указывать на их одинаковые функции в транскрипции, осуществляемой соответствующими ферментами, и на их возможное участие в координации функционирования разных РНК-полимераз.
РНК-полимераза I эукариот (Pol I). Как и большинство других высокомолекулярных полипептидов, большие субъединицы РНК-полимераз содержат хорошо различимые структурные и функциональные домены: дискретные участки полипептидных цепей, несущие конкретную функциональную нагрузку. Клонирование генов соответствующих субъединиц и определение их первичной структуры позволили выявить эволюционно консервативные участки полипептидных цепей и провести мутационный анализ функциональной значимости их отдельных доменов. Для этой цели в
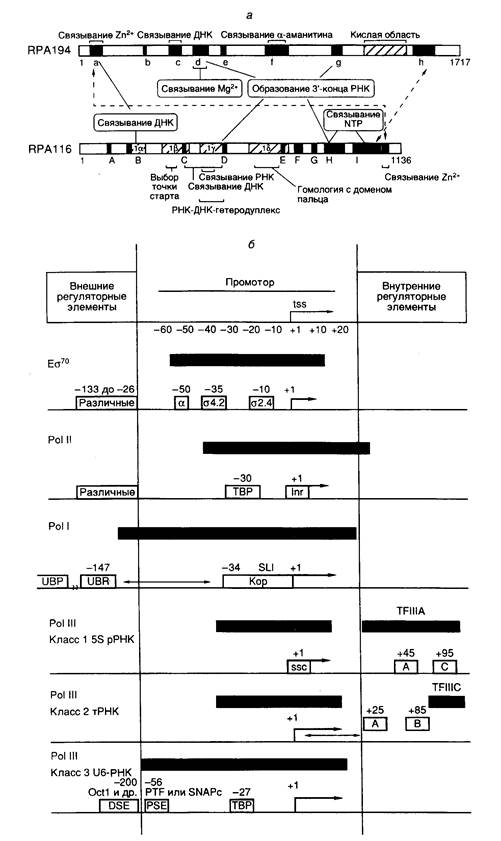
Рис. I.4. Структурные и функциональные домены больших субъединиц эукариотической РНК-полимеразы I (а) и особенности структуры промоторов эубактерий и эукариот (б)
а – Полипептидные цепи двух больших субъединиц изображены в виде горизонтальных прямоугольников, в которых черным цветом и латинскими буквами отмечены участки, консервативные у большинства известных РНК-полимераз. Кислая область и участки Ia-Id характерны для РНК-полимераз I. Обозначены зоны полипептидных цепей, формирующие активный центр фермента и необходимые для выполнения соответствующих функций (например связывания Mg2+). Пунктирные стрелки указывают на участки субъединиц, контактирующие друг с другом.
б – Незаштрихованными прямоугольниками обозначены известные структурные элементы промоторов, необходимые для инициации или активации транскрипции. Внутри прямоугольников приведены названия факторов транскрипции, взаимодействующих с соответствующими элементами промоторов, а также названия сайтов или взаимодействующих с ними белков, находящихся над сайтами. Стрелки «обозначают фиксированные расстояния между элементами промоторов, а ® – 5¢ -концевые части элонгируемых транскриптов. Черными прямоугольниками обозначены участки промоторов, защищаемые от действия ДНКазы I или других агентов Es70, а также эукариотическими транскрипционными комплексами, обеспечивающими базальный уровень транскрипции. tss – точка инициации транскрипции. Другие обозначения см. в тексте
полипептидных цепях с помощью направленного мутагенеза заменяли соответствующие аминокислоты и мутантные субъединицы использовали в сборке ферментов из отдельных субъединиц in vitro с последующим анализом свойств таких реконструированных ферментов. На рис. I.4, а суммированы данные, полученные для двух самых больших субъединиц (RPA194 и RPA116) Pol I мышей, которые являются функциональными аналогами β '- и β -субъединиц РНК-полимеразы E. coli.
РНК-полимераза I эукариот является большим ферментом, построенным по меньшей мере из 11 субъединиц. Минимальный фермент Pol I содержит два обсуждавшихся выше больших полипептида с молекулярной массой 194 и 116 кДа, которые ассоциированы с несколькими малыми субъединицами (от трех до 14 в зависимости от метода очистки), молекулярные массы которых лежат в пределах 15–60 кДа. Третья по величине субъединица Pol I мышей с молекулярной массой 53 кДа, названная PAF53 (polymerase associated factor 53), играет важную роль в узнавании Pol I своих промоторов и, по-видимому, является структурным и функциональным аналогом белка RPA49 дрожжей. Pol I дрожжей в отсутствие субъединиц RPA49 и RPA35.5 (так называемая Pol I*) эффективно транскрибирует при низких концентрациях солей искусственную матрицу poly[d(A-T)], но не нативную двухцепочечную ДНК. Полагают, что эти субъединицы необходимы для эффективного образования инициационных комплексов (см. ниже).
Используя антитела к отдельным субъединицам Pol I и последующую иммунопреципитацию, установили, что в клетке, по крайней мере, часть Pol I находится в составе больших комплексов, с которыми ассоциированы факторы транскрипции. Пять компонентов такого холофермента Pol I изучены в настоящее время наиболее детально.
Мышиный фактор TIF-IB (Pol I-specific transcription initiation factor B), известный также, как фактор D, обеспечивает Pol I селективность в отношении промоторов генов рРНК (рДНК). Аналогичный белок у человека назван hSL1, у крыс – rSL1 и у X. laevis – Rib 1. Взаимодействие фактора TIF-IB/SL1 с промотором рДНК обеспечивает связь холофермента Pol I с промотором и сборку прединициационного комплекса. Фактор TIF-IB/SL1 состоит из четырех субъединиц, одна из которых является основным фактором транскрипции TBP, необходимым для функционирования РНК-полимераз всех трех классов. (Подробнее об основных факторах транскрипции см. следующий раздел 2.1.3.) Три других субъединицы с молекулярными массами 110, 63 и 48 кДа представляют собой разные TBP-ассоциированные факторы TAFI, индивидуально и специфически взаимодействующие с TBP, а также друг с другом, образуя прочный комплекс. В составе комплекса TAFI48 обеспечивает контакт TIF-IB/SL1 с фактором UBF (см. ниже), а TAFI63 и TAFI110 участвуют в распознавании промотора. Факторы TAFI не обнаруживают гомологии с соответствующими факторами TAFII, специфичными в отношении Pol II. Более того, первый из связавшихся с TBP факторов TAFI предотвращает взаимодействие с TBP факторов TAFII (и наоборот), что делает невозможным образование непродуктивных химерных комплексов. Одновременно взаимодействие TAFI48 с TBP изменяет ДНК-связывающие свойства последнего, после чего тот перестает узнавать TATA-бокс – характерный структурный элемент Pol II-промоторов, и, следовательно, теряет способность обеспечивать инициацию транскрипции Pol II.
Другой белок, входящий в состав холофермента Pol I, UBF (upstream binding factor) высоко консервативен у разных видов животных. UBF является членом семейства факторов транскрипции, содержащих ДНК-связывающий HMG-домен (high mobility group domain) – основную последовательность из 80 аминокислот. С помощью ЯМР-спектроскопии установлено, что полипептидная цепь HMG-домена организована в три α -спирали, расположенные в виде буквы L, которые формируют три ДНК-связывающих поверхности с внешней стороны L. В клетке UBF присутствуют в двух формах – UBF1 и UBF2 с молекулярными массами 97 и 95 кДа, которые образуются в результате альтернативного сплайсинга. UBF1 содержит пять HMG-доменов, фланкированных N-концевым димеризующим мотивом и короткой кислой C-концевой последовательностью. Интересно, что соседние HMG-домены одного и того же UBF обладают гораздо меньшей гомологией, чем соответствующие домены UBF разных видов (например шпорцевой лягушки и человека). Полагают, что каждый HMG-домен обеспечивает особую, эволюционно консервативную функцию молекулы UBF. Такими функциями могут быть распознавание специфических последовательностей ДНК, создание молекулярных интерфейсов для белок–белковых взаимодействий между Pol I и TIF-IB/SL1, а также различными репрессорами и активаторами транскрипции рДНК. С-Концевая последовательность UBF содержит несколько фосфорилируемых остатков Ser и необходима для активации транскрипции рДНК. Одной из основных характеристик белков, содержащих HMG-бокс, является их способность изгибать молекулу ДНК и прочно связываться с ее крестообразными структурами. Всеми этими свойствами обладает UBF, и они детально исследованы.
Белок CPBF (core promoter binding factor), выделенный из асцитных клеток аденокарциномы молочных желез крыс, специфически взаимодействует с коровым участком промотора рДНК (о структуре промотора см. в разделе 2.1.2.). CPBF, прочно взаимодействующий с Pol I, состоит из двух субъединиц USF1 и USF2 с молекулярными массами 44 и 39 кДа соответственно. Гомодимеры USF1 и USF2 являются сильными ингибиторами транскрипции Pol I, тогда как гетеродимеры USF1/USF2 стимулируют транскрипцию in vitro. Полагают, что CPBF участвует в регуляции транскрипции Pol I in vivo.
TIF-IA – другой компонент холофермента Pol I, также участвует в регуляции синтеза рРНК этим ферментом. В его отсутствие инициационный комплекс не может образовывать первой фосфодиэфирной связи, а следовательно, и инициировать синтез РНК. TIF-IA освобождается после инициации транскрипции и может вновь входить в состав собирающихся прединициационных комплексов. По этим и ряду других критериев TIF-IA рассматривают в качестве функционального аналога бактериального фактора σ 70. TIF-IA является мономерным глобулярным белком с молекулярной массой 70–80 кДа. Активность этого фактора или его внутриклеточное содержание уменьшается при подавлении синтеза белка, истощении сыворотки или дифференцировке клеток и возрастает в ответ на митогенные стимулы, что коррелирует с подавлением или стимуляцией синтеза рРНК.
Хроматографически и с помощью иммунопреципитации было установлено, что жизненно важный фактор TIF-IC в растворе ассоциирован с Pol I. Этот фактор необходим как для сборки инициационных комплексов, так и образования первой фосфодиэфирной связи. Его присутствие предотвращает неспецифическую инициацию транскрипции и ее преждевременную терминацию, что проявляется в образовании гомогенных транскриптов правильной длины. По этим критериям фактор TIF-IC рассматривают в качестве функционального аналога TFIIF (RAP30/74) Pol II (см. ниже).
РНК-полимераза II (Pol II). Pol II человека содержит более 10 субъединиц, которые трудно назвать субъединицами в обычном смысле из-за слабой ассоциации друг с другом. Некоторые из них принадлежат к основным факторам транскрипции (GTFs – general transcription factors). Вообще же понятие холофермента Pol II эукариот не является устоявшимся. Лишь недавно в лабораториях Р.Янга и Р.Корнберга было установлено, что некоторые основные факторы транскрипции уже находятся в комплексе с РНК-полимеразой до ее включения в прединициационный комплекс. По мнению Янга, которое становится все более обоснованным, в состав холофермента Pol II дрожжей входят по меньшей мере 14 белков и белковых комплексов, перечисленных в табл. I.3.
Таблица I.3