
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Металлические кристаллы
|
|
Металлы характеризуются высокой электропроводностью, которая обусловливается коллективизацией валентных электронов. С точки зрения электронной теории металл состоит из положительных ионов, погруженных в среду, образованную коллективизированными электронами. Последние могут свободно перемещаться в объеме кристалла, так как они не связаны с определенными атомами. Причем кинетическая энергия коллективизированных электронов уменьшается по сравнению с кинетической энергией валентных электронов в свободном атоме.
Связь в металлических кристаллах возникает в результате взаимодействия положительных ионов с коллективизированными электронами. Свободные электроны, которые находятся между ионами, как бы стягивают их, уравновешивая силы отталкивания между ионами одного знака. С уменьшением расстояния между ионами растет плотность электронного газа, а, следовательно, увеличиваются силы притяжения. Однако при этом начинают расти и силы отталкивания. При достижении некоторого расстояния между ионами силы уравновешиваются, и решетка становится устойчивой.
Таким образом, энергию металлического кристалла можно представить в виде следующих слагаемых:
– электростатическая энергия свободных электронов в поле положительных ионов (решетки кристалла);
– кинетическая энергия электронов;
– взаимная электростатическая потенциальная энергия положительных ионов;
– взаимная электростатическая потенциальная энергия электронов.
Можно показать, что существенны только первые два слагаемые. В качестве примера рассмотрим металлический натрий, который имеет ОЦК решетку. Выделим в решетке объем, приходящийся на один атом, проведя для этого плоскости, перпендикулярные линиям, соединяющими данный атом с соседями, и делящие указанные отрезки пополам. Получим так называемую ячейку Вигнера-Зейтца, которая для данной решетки имеет форму кубооктаэдра (см. гл.1).
Хотя электроны перемещаются по всему кристаллу, возле каждого атома, то есть в ячейке Вигнера-Зейтца, электронная плотность в среднем постоянна. Это значит, что если в металле приходится один электрон на атом, то в среднем вблизи каждого атома находится один электрон. Кубооктаэдры оказываются электрически нейтральными и электростатически взаимодействуют между собой слабо. Основная часть взаимодействия сосредоточена внутри кубоэктаэдров, то есть отвечает энергии свободных электронов в поле положительных ионов.
Вероятность нахождения электрона на расстоянии между  и
и 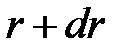 от данного иона определяется следующим выражением
от данного иона определяется следующим выражением
 ,
,
где  – плотность вероятности (квадрат модуля радиальной части волновой функции). Тогда энергия электрона в поле данного иона равна
– плотность вероятности (квадрат модуля радиальной части волновой функции). Тогда энергия электрона в поле данного иона равна
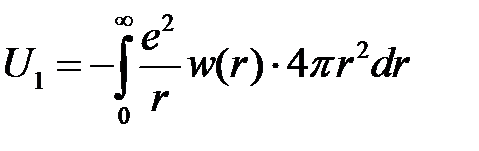 ,
,
то есть величине  , усредненной по всем возможным положениям электрона. Поскольку область интегрирования равна всему объему металла, то результат интегрирования определит энергию всех свободных электронов в поле данного иона, если
, усредненной по всем возможным положениям электрона. Поскольку область интегрирования равна всему объему металла, то результат интегрирования определит энергию всех свободных электронов в поле данного иона, если 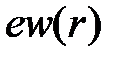 представляет среднюю плотность заряда в решетке.
представляет среднюю плотность заряда в решетке.
Из выше сказанного следует, что слагаемое энергии, отвечающее взаимной потенциальной энергии электронов и ионов, будет иметь вид
 , (2.62)
, (2.62)
где 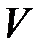 – объем металла, а – некоторая постоянная (а < 0).
– объем металла, а – некоторая постоянная (а < 0).
Определим кинетическую энергию электронов. Рассмотрение этого вопроса будет проведено в гл.4, а сейчас воспользуемся полученными в ней результатами. Средняя кинетическая энергия электронов определяется через энергию Ферми[5] 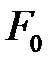 и составляет
и составляет
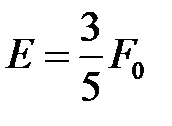 ,
,
где 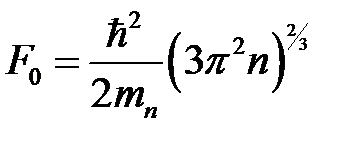 ;
; 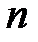 – концентрация электронов. Последняя определяется количеством атомов
– концентрация электронов. Последняя определяется количеством атомов 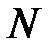 и объемом металла
и объемом металла  . Окончательно энергия
. Окончательно энергия  может быть представлена в виде
может быть представлена в виде
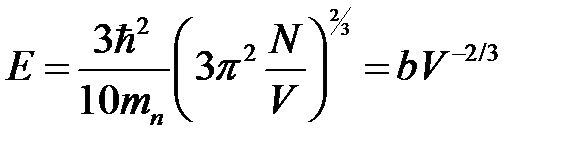 . (2.63)
. (2.63)
Полная энергия металлического кристалла, согласно предыдущему, определяется двумя слагаемыми
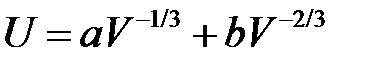 . (2.64)
. (2.64)
Если построить зависимость 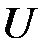 как функцию расстояния между атомами
как функцию расстояния между атомами 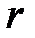 , то есть величины пропорциональной
, то есть величины пропорциональной 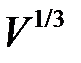 , получится кривая с минимумом в точке
, получится кривая с минимумом в точке  (рис.2.6). Значение
(рис.2.6). Значение 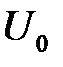 в этом минимуме определяет энергию связи, а вторая производная в этой точке – модуль сжимаемости. Роль сил отталкивания в случае металлических кристаллов играет кинетическая энергия электронов, которая возрастает при уменьшении межатомных расстояний.
в этом минимуме определяет энергию связи, а вторая производная в этой точке – модуль сжимаемости. Роль сил отталкивания в случае металлических кристаллов играет кинетическая энергия электронов, которая возрастает при уменьшении межатомных расстояний.
| Рис.2.6. Зависимость энергии металлического кристалла от межатомного расстояния |
Расчет энергии связи (теплоты испарения) металлического натрия по приведенной выше схеме дает величину около 1 эВ/атом, что хорошо совпадает с экспериментальными данными – 1, 13 эВ/атом.
В силу того, что чисто металлическая связь ненаправленная, металлы кристаллизуются в относительно плотно упакованные структуры с большими координационными числами: гранецентрированную кубическую (ГЦК), гексагональную плотно упакованную (ГПУ), объёмно-центрированную кубическую. Для ГЦК и ГПУ кристаллов плотность упаковки и координационное число одинаковы: 0, 74 и 12 соответственно. Следовательно, близость параметров свидетельствует о близости значений энергии связи в таких кристаллах. Действительно, ряд металлов может при относительно слабом внешнем воздействии изменять структуру из ГЦК на ГПУ и наоборот.
В некоторых металлах действуют не только металлические связи, обусловленные коллективизированными электронами, но и ковалентные связи, для которых характерна локализация атомных орбиталей в пространстве. В кристаллах переходных металлов преобладает ковалентная связь, возникновение которой связано с наличием незастроенных внутренних оболочек, а металлическая связь имеет подчиненное значение. Поэтому энергия связи в таких кристаллах значительно больше по сравнению со щелочными металлами. Например, у никеля она в четыре раза выше, чем у натрия.
Такие металлы могут иметь и более низкосимметричные решетки, чем у щелочных и благородных металлов.
Следует отметить, что многие вещества, которые при нормальных условиях являются диэлектриками или полупроводниками, при увеличении давления испытывают фазовые переходы и приобретают металлические свойства. Вынужденное сближение атомов усиливает перекрывание электронных оболочек, которое способствует обобществлению электронов. Например, полупроводник 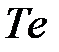 становится металлом при давлении ~4 ГПа,
становится металлом при давлении ~4 ГПа, 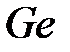 – при 16 ГПа,
– при 16 ГПа, 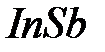 – при 2 ГПа. Имеются гипотезы, что при давлении ~2000ГПа в металлическое состоянии может перейти молекулярный водород, причем фаза может оказаться стабильной после снятия давления и может оказаться сверхпроводящей.
– при 2 ГПа. Имеются гипотезы, что при давлении ~2000ГПа в металлическое состоянии может перейти молекулярный водород, причем фаза может оказаться стабильной после снятия давления и может оказаться сверхпроводящей.