
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Термодинамічні основи процесу стиснення газів
|
|
1. Рівняння стану газу термодинамічні діаграми. Стиснення реального газу супроводжується зміною його об'єму, тиску і температури. Співвідношення між цими параметрами при тиску не більше 106 н/м2 (~10ат ) характеризується рівнянням стану ідеальних газів.
При тиску більше 106 н/м2 (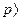 10ат ) слід користуватися рівнянням Ван-дер-Ваальса або іншим рівнянням, що більш точно описує залежність між об'ємом, тиском і температурою газу при підвищеному тиску.
10ат ) слід користуватися рівнянням Ван-дер-Ваальса або іншим рівнянням, що більш точно описує залежність між об'ємом, тиском і температурою газу при підвищеному тиску.
Рівняння Ван-дер-Ваальса має вигляд
 (4.1)
(4.1)
де р—тиск газу, н/м2; v — питомий об'єм газу, м3/кг, R - газова постійна R=8314/M, дж/(кг× град); М— маса 1 кмоль, кг/кмоль; Т— температура °К; а, в— постійні величини для даного газу.
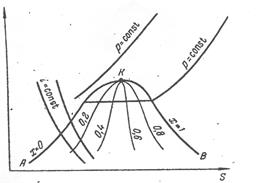
Рис.1. Термодинамічна діаграма температура—ентропія, або Т—S-діаграма
За відсутності довідкових даних постійні а і в визначаються за критичними параметрами газу — критичними температурою Ткр і тиском Ркр:
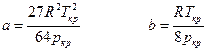
Проте для практичних розрахунків найбільш зручна і надійна термодинамічна діаграма температура—ентропія, або Т—S-діаграма, яка будується на підставі дослідних даних (рис.1).
На Т—S-діаграмі нанесена пригранична крива АКВ, максимум на якій відповідає критичній точці К. В області, обмеженій цією кривою і віссю абсцис (область вологої пари), т.т. одночасно співіснують дві фази — рідина і пара. Ліва гілка КА приграничної кривої відповідає повної конденсації пари (зникненню парової фази). Для неї ступінь сухості х=0. Права гілка КВ відповідає повному випаровуванню рідини (зникненню рідкої фази) і утворенню сухої пари. Для гілки КВ ступінь сухості х=1. Зліва від приграничної кривої знаходиться область існування тільки рідкої фази, справа — тільки парової (газоподібної) фази. Координати критичної точки К характеризують критичні параметри газу.
В області вологої пари проведені лінії постійної вологості  . Лінії постійних температур (ізотерми) і ентропії
. Лінії постійних температур (ізотерми) і ентропії  паралельні відповідно абсцисі і ординаті. Вибрані
паралельні відповідно абсцисі і ординаті. Вибрані  в області перегрітої пари направлені круто вгору, а в області вологої пари співпадають з ізотермами, оскільки тепло тут витрачається на випаровування рідини без зміни температури. В області рідкої фази ізобари майже повністю зливаються з приграничною кривою унаслідок незначного стиснення рідин і незначного впливу тиску на їх фізичні властивості.
в області перегрітої пари направлені круто вгору, а в області вологої пари співпадають з ізотермами, оскільки тепло тут витрачається на випаровування рідини без зміни температури. В області рідкої фази ізобари майже повністю зливаються з приграничною кривою унаслідок незначного стиснення рідин і незначного впливу тиску на їх фізичні властивості.
На діаграмі Т—S нанесені також лінії постійної ентальпії  (ізоентальпи). Ентальпія реальних газів залежить не тільки від температури, але і від тиску, тому ізоентальпа реальних газів не співпадає з ізотермою.
(ізоентальпи). Ентальпія реальних газів залежить не тільки від температури, але і від тиску, тому ізоентальпа реальних газів не співпадає з ізотермою.
Всі параметри газу на Т—S-діаграмі віднесені до 1 кг газу.
Відповідно до термодинамічного визначення ентропії приріст її для оборотного процесу складає
 (4.2)
(4.2)
За цим рівнянням можна розрахувати теплоту зміни стану газу:
 (4.3)
(4.3)
Таким чином, на діаграмі Т—S площа під кривою, що описує зміну стану газу, чисельно рівна теплоті зміни стану.
Застосування діаграми тиск - об'єм (P-V) для проведення технічних розрахунків можливе, проте викликає значні труднощі у зв'язку з складністю визначення теплоти зміни стану газу на цій діаграмі.
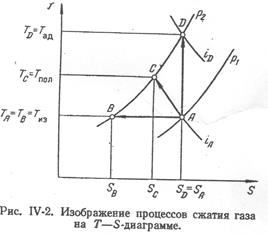 2. Процеси стиснення газів.
2. Процеси стиснення газів.
Кінцевий тиск газу під час стиснення залежить від умов теплообміну газу з навколишнім середовищем. Теоретично є два граничні випадки стиснення:
1) все що виділяється при стисненні тепло повністю відводиться і температура газу при стисненні залишається незмінною - ізотермічний процес;
2) теплообмін газу з навколишнім середовищем повністю відсутній і все що виділяється при стисненні тепло затрачується на збільшення внутрішньої енергії газу, підвищуючи його температуру, — адіабатичний процес.
Насправді стиснення газу лише в більшій або меншій ступені наближається до одного з цих теоретичних процесів. При стисненні газу разом із зміною його об'єму і тиску відбувається зміна температури і одночасно частина тепла, що виділяється, відводиться в оточуюче середовище. Такий процес стиснення називається політропічним.
3. Робота стиснення і споживана потужність.
Процес ізотермічного стиснення газу від тиску р1 до тиску р2 зображається на Т—S діаграмі прямою АВ (рис. 2), проведеній між ізобарами P1 і P2 по лінії 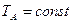 .
.
Кількість тепла qіз, яке необхідно відводити при ізотермічному стисненні 1 кг газу від тиску р1 до тиску р2 допівнює питомій роботі ізотермічного стиснення 1із, вираженій в дж/кг. Величина qіз може бути визначена з діаграми за допомогою простого співвідношення:
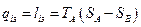 (4.4)
(4.4)
Процес адіабатичного стиснення газу характеризується повною відсутністю теплообміну між газом і навколишнім середовищем. При адіабатичному стисненні газу dQ = 0 і з рівняння (4.2) випливає, що dS= 0. Таким чином, в процесі адіабатичного стиснення газу незмінною залишається його ентропія, і цей процес зображається на діаграмі Т—S прямою АD (рис.4.2), проведеній по лінії  .
.
Кількість тепла, що виділяється при адіабатичному стисненні 1 кг газу від тиску р1 до тиску р2, дорівнює питомій роботі адіабатичного стиснення, визначається по діаграмі таким чином:
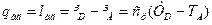 (4.5)
(4.5)
Процес політропічного стиснення газу від тиску р1 до тиску р2 зображається на діаграмі Т—S похилою прямою АС. Кількість тепла, що виділяється при політропічному стисненні 1 кг газу, чисельно рівне питомій роботі політропічного стиснення 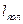 , знаходиться приблизно з діаграми по співвідношенню:
, знаходиться приблизно з діаграми по співвідношенню:
 (4.6)
(4.6)
Знаючи кінцевий тиск р2, можна визначити питому роботу стиснення l також аналітично. Вона дорівнює для ізотермічного стиснення:
 (4.7)
(4.7)
для адіабатичного стиснення
 (4.8)
(4.8)
для політропічного стиснення
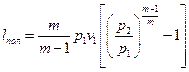 (4.9)
(4.9)
У рівняннях (4.7—4.9): v1 - питомий об'єм газу при всмоктуванні, м3/кг; 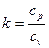 - показник адіабати (відношення теплоємності газу при постійному тиску до теплоємності при постійному об'ємі); m — показник політропи.
- показник адіабати (відношення теплоємності газу при постійному тиску до теплоємності при постійному об'ємі); m — показник політропи.
Значення показника політропи m залежить від природи газу і умов теплообміну з навколишнім середовищем. Так, наприклад, при стисненні повітря в компресорах, що працюють з водяним охолодженням газу, приблизно можна прийняти m = 1, 35. У компресорах без охолодження стиснення може протікати по адіабаті або по політропі з показником  .
.
Найменша робота затрачається під час ізотермічного стиснення, тому дійсний процес стиснення прагнуть провести в умовах, наближених до ізотермічних. Для цього тепло, що виділяється при стисненні відводять шляхом охолодження газу. Температура газу Т2 після стиснення: для ізотермічного процесу
 (4.10)
(4.10)
для адіабатичного процесу
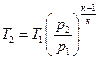 (4.11)
(4.11)
для політропічного процесу
 (4.12)
(4.12)
Теоретична потужність NT (вт), затрачена на стиснення газу компресором, визначається множенням продуктивності компресора Vr (кг/сек) на питому роботу стиснення l (дж/кг), підраховану по одному з приведених вище рівнянь (4.7)—(4.9):
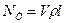 (4.13)
(4.13)
де V — об'ємна продуктивність компресора,  — густина газу, кг/м3.
— густина газу, кг/м3.
Якщо об’ємна продуктивність компресора і щільність газу приведені до умов всмоктування (т.т. якщо V=V1 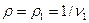 ), то у врахуванням рівнянь (4.7-4.9) отримаєм:
), то у врахуванням рівнянь (4.7-4.9) отримаєм:
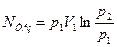 (4.13 а)
(4.13 а)
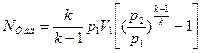 (4.13 б)
(4.13 б)
 (4.13 в)
(4.13 в)
Ефективність компресорів неможна оцінювати звичайним енергетичним ккд, який являє собою відношення енергії, отриманої газом в машині, до затраченої енергії. При такій оцінці ефективності найменший ккд мали б машини з інтенсивним водяним охолодженням, оскільки значна частина енергії стиснених у цих машинах газів відводиться у вигляді тепла з охолоджуючою водою. Проте, як відомо, задане підвищення тиску газу досягається з найменшою затратою енергії саме в машинах із інтенсивним водяним охолодженням. Тому для оцінки ефективності компресорних машин застосовують відносний термодинамічний ккд, який базується на порівнянні даної компресорної машини з найбільш економічною машиною того ж класу.
Машини з водяним охолодженням порівнюють із умовною машиною, стискаючою газ по ізотермі. Така машина називається ізотермною. Відношення потужності ізотермної машини  до фактичної потужності N даної машини, працюючої з охолодженням газу, називається ізотермічним ккд
до фактичної потужності N даної машини, працюючої з охолодженням газу, називається ізотермічним ккд 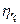
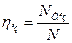 (4.14)
(4.14)
У компресорах, які працюють без охолодження газу, відбувається додаткове нагрівання його в результаті відсутності відводу тепла, який виділяється під час тертя швидкорухаючихся деталей машин у газ, внаслідок гідравлічних опорів і інших причин. Стиснення газу в таких машинах протікає по політропі, показник якої  . Тому потужність стиснення в неохолоджуючих компресорах прийнято порівнювати з потужністю стиснення в умовній машині, стискаючій газ по адіабаті (ізоентропно). Ця машина називається ізоентропною і є найбільш економічною машиною з класу компресорів, працюючих без охолодження газу. Відношення потужності стиснення ізоентропної машини
. Тому потужність стиснення в неохолоджуючих компресорах прийнято порівнювати з потужністю стиснення в умовній машині, стискаючій газ по адіабаті (ізоентропно). Ця машина називається ізоентропною і є найбільш економічною машиною з класу компресорів, працюючих без охолодження газу. Відношення потужності стиснення ізоентропної машини  до потужності N даного компресора, працюючого без охолодження газу, називається ізоентропним (адіабатичним) ккд
до потужності N даного компресора, працюючого без охолодження газу, називається ізоентропним (адіабатичним) ккд  :
:
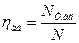 (4.15)
(4.15)
Потужність на валу Nе компресора дорівнює потужності N, витраченої на стиснення газу, поділеної на механічний ккд 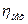 , характеризуючий втрати потужності на механічне тертя в компресорі
, характеризуючий втрати потужності на механічне тертя в компресорі
 (4.16)
(4.16)
Чи з врахуванням виразу (4.14)
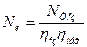 (4.17)
(4.17)
Добуток ізотермічного і механічного ккд називається повним ізотермічним ккд компресора  :
:
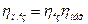
Потужність двигуна Nдв більше потужності на валу компресора внаслідок втрат потужності в передачі і в самому двигуні. Ці втрати оцінюються ккд передачі  і ккд двигуна
і ккд двигуна 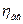 :
:

Установлена потужність двигуна Nуст звичайно приймається з запасом 10-15%, т.т.
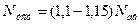
Значення адіабатичного ккд 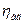 близьке до одиниці і змінюється в межах 0, 93-0, 97. ізотермічний ккд
близьке до одиниці і змінюється в межах 0, 93-0, 97. ізотермічний ккд 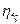 у залежності від ступеня стиснення має значення 0, 64-0, 78. значення механічного ккд
у залежності від ступеня стиснення має значення 0, 64-0, 78. значення механічного ккд 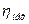 знаходиться в межах 0, 85-0, 95.
знаходиться в межах 0, 85-0, 95.
Література: Касаткин А.Г. Основные процессы и аппараты химической технологий. – М.: Химия, 1973. - С. 152-157