
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Применение сложных эфиров органических кислот
|
|
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты - ацетаты. Прочие эфиры (кислот молочной - лактаты, масляной - бутираты, муравьиной - формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемости и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот, а также алкиленкарбонаты. Физико-химические свойства наиболее распространенных сложных эфиров приведены в таблице (см. приложение).
Метилацетат СН3СООСН3. Отечественной промышленностью технический метилацетат выпускается в виде древесно-спиртового растворителя, в котором содержится 50% (масс.) основного продукта. Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон.
Этилацетат С2Н5СООСН3. Получают методом этерификации на лесохимических предприятиях при переработке синтетической и лесохимической уксусной кислоты, гидролизного и синтетического этилового спирта или конденсацией ацетальдегида. За рубежом разработан процесс получения этилацетата на основе метилового спирта.
Этилацетат подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести). Добавка 15-20 % этилового спирта повышает растворяющую способность этилацетата в отношении эфиров целлюлозы, особенно ацетилцеллюлозы.
Пропилацетат СН3СООСН2СН2СН3. По растворяющей способности подобен этилацетату.
Изопропилацетат СН3СООСН(СН3)2. По свойствам занимает промежуточное положение между этил- и пропилацетат.
Амилацетат CH3COOCH2CH2CH2CH2CH3, т. кип. 148° С, иногда называют «банановым маслом» (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто – сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Винилацетат CH2=CHOOCCH3, образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок.
Мыла — это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
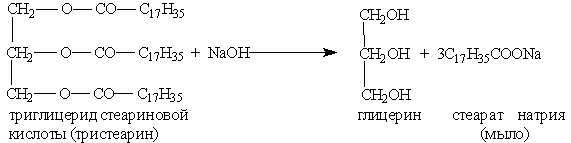
Обычное мыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так как содержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли:
Ca2+ + 2C17H35COONa→ Ca(C17H35COO)2↓ + 2Na+
В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды.
Применение простых эфиров
определяется, в основном, тем, что они очень хорошо растворяют многие жиры, смолы и лаки. Наиболее широко используют ДИЭТИЛОВЫЙ ЭФИР (С2Н5)2О, техническое название – «серный эфир», поскольку его получают в присутствии серной кислоты (рис. 4В). Помимо применения в качестве растворителя, а также в роли реакционной среды при проведении различных органических синтезов его используют и для экстрагирования (извлечения) некоторых органических веществ, например, спиртов, из водных растворов, поскольку сам эфир очень мало растворим в воде. В медицине серный эфир применяют для наркоза.
Диизопропиловый эфир (СН3)2СНОСН(СН3)2 используют как растворитель и как добавку к моторному топливу для повышения октанового числа.
Анизол С6Н5ОСН3 (рис. 4) и ФЕНЕТОЛ С6Н5ОС2Н5 (рис. 3) используют в качестве промежуточных продуктов при получении красителей, лекарств и душистых веществ.
Дифениловый эфир (дифенилоксид) (С6Н5)2О из-за высокой температуры кипения (259, 3° С) и химической устойчивости применяют как теплоноситель. Чтобы при остывании до комнатной температуры он не переходил в твердое состояние (его т. пл. 28–29° С), в него добавляют дифенил (С6Н5)2. Такая смесь, называемая в технике даутермом, может работать как теплоноситель в широком диапазоне температур.
Диоксан, циклический эфир (СН2СН2О)2 (рис.), по химическим свойствам близок обычным простым эфирам, но в отличие от них неограниченно смешивается с водой и большинством органических растворителей. Растворяет жиры, воски, масла, эфиры, целлюлозы, его широко применяют и как реакционную среду при проведении различных органических синтезов.
Экологические аспекты влияния на организм человека и окружающую среду
ПЭ — летучие наркотики; раздражают слизистые глаз, верхних дыхательных путей. Пары непредельных ПЭ и их галогенпроизводных раздражают сильнее (дивиниловый Э. является исключением). Фтор- и хлорпроизводные ПЭ поражают паренхиматозные органы: печень, почки. ПЭ двух- и трехатомных спиртов в меньшей степени характеризуются наркотическим действием, но обладают более выраженным общетоксическим действием. Наибольшей способностью проникать через кожу обладают ПЭ фенолов. Полигликолевые ПЭ, т. н. карбоваксы, практически индифферентны, вредного действия в условиях производства не обнаружено.
Основные пути поступления ПЭ в организм в производственных условиях — верхние дыхательные пути и кожа. При отравлениях на производстве у рабочих наблюдаются симптомы поражения ЦНС: возбуждение, сонливость, вплоть до глубокого сна. У стажированных рабочих нередки жалобы на головную боль, тошноту, отсутствие аппетита. Отмечаются симптомы раздражающего действия: слезотечение, блефароспазм, конъюнктивиты, риниты, бронхиты, трахеиты, воспаление легких. В отдельных случаях — местное действие на кожу от покраснения до развития выраженной воспалительной реакции. В крови — изменения количества эритроцитов, лейкоцитов, снижение гемоглобина. Встречаются вегетативная лабильность, снижение сухожильных рефлексов, сердечно-сосудистые расстройства, поражения почек.
Насыщение организма ПЭ при вдыхании высоких концентраций происходит очень быстро; распределение по органам равномерное, с преимущественным накоплением в жировой ткани, железах внутренней секреции. Выведение в неизмененном виде (до 90%) с выдыхаемым воздухом и частично с мочой.
Сложные эфиры
Большинство СЭ характеризуются невысокой токсичностью (за исключением Э. фосфорной, тиофосфорной, дитиофосфорной, пирофосфорной, фосфоновой кислот); относятся к умеренно и малотоксичным соединениям. Благодаря высокой растворимости паров в воде, накопление в организме происходит довольно медленно, вследствие чего внезапные острые отравления СЭ на производстве маловероятны. При любом пути поступления СЭ оказывают преимущественно наркотическое действие. Наркотические свойства СЭ в гомологическом ряду определяются действием целой молекулы и возрастают с увеличением числа атомов углерода; токсичность изомеров всегда меньше их неразветвленных гомологов.
Степень выраженности наркотических свойств определяется скоростью гидролиза СЭ в организме. Гидролитическое ращепление молекулы СЭ происходит по месту эфирной связи с образованием кислотного и спиртового компонентов, которые придают характеру биологического действия новые черты. Скорость гидролиза СЭ различна внутри гомологических рядов; в ряду метиловых и этиловых СЭ наибольшая — у средних членов ряда (4—6 атомов углерода). Дальнейшее увеличение количества атомов углерода сопровождается уменьшением скорости гидролиза и нарастанием наркотического эффекта.
СЭ проявляют раздражающие свойства, определяемые наличием двойной связи в кислотном или спиртовом радикале. На характер действия СЭ могут оказывать влияние входящие в состав функциональные группы, напр. ONO, благодаря которой Э. азотистой кислоты (метилнитрит) действуют преимущественно как вещества, вызывающие расширение артерий и быстрое падение кровяного давления.
Введение в молекулу СЭ галоидов (хлор, фтор, бром), как правило, приводит к усилению общей токсичности за счет появления раздражающего действия. Включение серы в молекулу СЭ повышает жирорастворимость, способность проникать через неповрежденную кожу. Присутствие серы в молекуле СЭ сопровождается повышением токсичности, а также усилением местного раздражающего действия на кожу и слизистые (диметилсульфат, диэтилксантогенат). СЭ жирных кислот (муравьиной, щавелевой) и метилового спирта более токсичны в результате образования высокотоксичных метаболитов. СЭ двухосновных кислот и их производных проявляют более выраженное токсическое действие вследствие способности всасываться через кожные покровы. СЭ ароматических кислот малолетучи и поэтому относительно менее опасны. Как правило, не вызывают острых отравлений, однако длительный контакт приводит к развитию патологии верхних дыхательных путей, глаз и паренхиматозных органов.
Для СЭ в условиях производства имеют значение 2 пути поступления в организм: через кожу и верхние дыхательные пути. Наличие наркотического эффекта, характерного для большинства СЭ, определяет некоторые общие симптомы в клинике острого отравления: возбуждение, нарушение координации движений с последующим угнетением ЦНС. Повторное воздействие СЭ сопровождается потерей веса, изменением потребления кислорода и картины крови: лейкоцитоз, нарушения содержания гемоглобина, эритроцитоз, сдвиг формулы. Хронические отравления могут приводить к дистрофическим изменениям печени, почек, развитию патологии сердечно-сосудистой системы.