
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Антибиотики группы цефалоспоринов
|
|
В данную группу входят природные антибиотики и их полусинтетические производные. Все они содержат 7-аминоцефалоспорановую кислоту /7 АЦК/, сходную по химической структуре с 6-АПК антибиотиков группы пенициллина. Однако имеющиеся различия определяют устойчивость цефалоспоринов к пенициллиназе стафилококков и их высокую эффективность в отношении устойчивых к пенициллину штаммов стафилококков.
Цефалоспорины /цефалоридин, цефалексин, кефзол/ являются препаратами широкого спектра действия. Они действуют бактерицидно на гр + и гр - кокки, некоторые гр + и гр - палочки и, как было отмечено ранее, действуют на устойчивые к пенициллину штаммы стафилококка, но не действуют на метициллинорезистентные стафилококки. У беталактамных антибиотиков антимикробное действие основано на ингибиции ферментов, ответственных за синтез пептидогликана клеточной стенки бактерий. Эти ферменты называются пенициллинсвязывающими белками.
Тетрациклины
К ним относятся природные антибиотики /тетрациклин, окситетрациклин и др./ и их полусинтетические производные. В основе их химического строения лежит конденсированная четырехциклическая система - " тетрациклин". Отличаются они друг от друга по наличию дополнительной ОН, CI и СН2 - группы /окситетрациклин, морфоциклин, хлортетрациклин/. Тетрациклины обладают широким спектром действия. Они оказывают бактериостатическое действие на гр + и гр - кокки, палочки, спирохеты, риккетсии, хламидии, микоплазмы, некоторые простейшие /возбудители амебиаза/.
Механизм антибактериального действия обусловлен нарушением синтеза белка на рибосомах. Бактериостатическое действие данных антибиотиков в отношении риккетсий провацека связано с тем, что подавляется окисление глютаминовой кислоты, которая играет важную роль в энергетическом метаболизме риккетсий.
Препараты группы стрептомицина
Из препаратов данной группы применяют стрептомицина сульфат, стрептосульмицина сульфат, стрептомицина хлоркальциевый комплекс, дигидрострептомицина сульфат и дигидрострептомицина пантотенат. Препараты группы стрептомицина относятся к препаратам с широким спектром действия. Они действуют бактерицидно на большинство гр - и гр + бактерий. Они активны в отношении туберкулезных микобактерий. Стрептомицин относится к основным противотуберкулезным препаратам. Они не оказывают антимикробного действия на большинство анаэробных микроорганизмов, спирохеты, риккетсии, хламидии и микоплазмы.
Механизм действия связан с подавлением синтеза белка на уровне рибосом в микробной клетке.
Антибиотики-аминогликозиды.
Характерным структурным элементом антибиотиков данной группы является 2-лезокси-Д-стрептомин, т.е. их структура сходна со структурой стрептомицина. К данной группе относят неоглицин, мономицин, канамицин, гентамицин и др.
Данная группа антибиотиков обладает широким спектром действия. Они действуют бактерицидно на гр + и гр - бактерии.
В основе механизма действия лежит подавление синтеза белка на уровне рибосом.
Актибиотики-макролиды.
Макролидами называют соединения, в структуре которых содержится макроциклическое лактонное кольцо. К этой группе относятся эритромицин и олеандомицин.
Эритромицин активен в отношении гр + и гр - кокков, некоторых гр + и гр - палочек, спирохет, риккетсий и хламидий. Не действует на большинство гр - палочек и на туберкулезные микобактерии. Спектр действия олеандомицина напоминает эритромицин. В терапевтических дозах данные антибиотики оказывают бактериостатическое действие. Эритромицин и олеандомицин входят в состав комбинированных препаратов. Например, эрициклин - смесь эритромицина с окситетрациклином и олететрин - смесь олеандомицина фосфата с тетрациклином. Но механизму действия макролиды подавляют синтез белка на уровне рибосом.
Препараты группы левомицетина.
Левомицетин - синтетическое вещество, которое идентично хлорамфениколу - природному антибиотику. Действует бактериостатически на гр + и гр - кокки и палочки, спирохеты, риккетсии и хламидии, не оказывает антимикробного действия на патогенные анаэробные бактерии, туберкулезные микобактерии и синегнойную палочку.
Выпускаются комбинированные препараты в аэрозольных упаковках: легразоль /содержит левомицетин, грамицидин и др. компоненты/ и левовинизоль /смесь левомицетина, винилина, спирта и др./. Левомицетин /хлорамфеникол/ входит в состав мази " Ируксол", которая обладает антимикробными свойствами.
К группе левомицетина относится и синтомицин, идентичный с ним по химической структуре. Левомицетин является левовращающейся формой, а синтомицин правовращающейся формой одного и того же соединения. Действующим началом синтомицина является левомицетин. Синтомицин применяют для наружного употребления в виде линементов, свечей и т.д.
По механизму действия они откосятся к антибиотикам, подавляющим синтез белка на уровне рибосом.
Рифамицины.
К данной группе относятся природный антибиотик рифамицин и его полусинтетический аналог - рифампицин.
Указанные антибиотики действуют бактерицидно в отношении гр + бактерий и туберкулезных микобактерий. Рифампицин отличается от рифамицина в основном тем, что он эффективен при приеме через рот и имеет несколько больший спектр действия /активен в отношении гонококков и др. бактерий/.
Препараты группы фторхинолонов.
В данную группу входят норфлоксацин, гирамид /эноксацин/, максиквин /ломефлоксацин/, таривид /офлоксацин/, абактал /нефлоксицин/, ципролет /ципрофлоксацин/, хинодис /флефлоксицин/. Норфлоксацин, гирамид, максиквин активны в отношении гр - кокков, палочек, некоторых гр + бактерий. Действуют на бактерии, продуцирущие беталактамазы. Хинодис действует на гр - кокки и палочки, исключая синегнойную палочку.
Наиболее широким спектром действия обладают таривид и ципролет. Таривид оказывает бактерицидное действие на гр - кокки и палочки. Активен в отношении стафилококков, легионелл, микоплазм, хламидий. Действует на микроорганизмы, продуцирующие β -лактамазы. Механизм действия связан с угнетением активности хромосомной и плазмидной ДНКазы бактерий, что нарушает репликацию ДНК у данных микроорганизмов.
Ципролет действует бактерицидно на гр + и гр - микроорганизмы, включая протей, холерный вибрион, псевдомонады, бруцеллы, листерии, легионеллы, хламидии, микоплазмы, анаэробные бактерии /бактероиды, клостридии/ и др. Он действует на штаммы, устойчивые к антибиотикам из групп пенициллина, цефалоспоринов и аминогликозидов. Механизм действия связан с тем, что ципролет блокирует синтез ДНК бактерий и нарушает функции ДНК. Кроме того, он повреждает клеточные мембраны бактерий, в результате чего происходит вытекание содержимого клетки.
Антибиотики разных групп.
Сюда относят линкомицин, ристомицин, фузидин-натрия, полимиксины и грамицидин.
Линкомицин оказывает бактериостатическое действие на гр/+/ кокки, некоторые гр/+/ палочки /дифтерийные коринебактерии, возбудители газовой гангрены, столбняка/ и микоплазмы. Механизм действия его связан с подавлением синтеза белка бактерий. Ристомицин активен в отношении гр + кокков, гр + палочек и кислотоустойчивых бактерий.
Антибиотическое вещество - натриевая соль фузидиевой кислоты, продуцируется грибом Fusidium coccineum. Фузидин действует бактериостатически на гр + кокки, исключая стрептококки и гр - кокки, т.е. обладает узким спектром действия. Механизм действия связан с подавлением синтеза белка микробной клетки.
Полимиксины.
В эту группу входят полимиксина М сульфат, полимиксина В сульфат. Полимиксины действуют на гр - палочковидные микроорганизмы. Особенностью данных препаратов является действие их на синегнойную палочку. Полимиксин М применяется лишь для наружного употребления и через рот. Полимиксин В применяется парэнтерально.
Грамицидин /грамицидин С/.
Он оказывает антимикробное действие на гр + кокки, возбудители анаэробной инфекции и др. бактерии. Применяется только мест- но в виде промывания, орошения, повязки.
Грамицидиновая паста применяется как антимикробное средство и как контрацептивное, т.к. грамицидин убивает сперматозоиды.
Противогрибовые антибиотики
К данной группе антибиотиков относят нистатин, леворин, амфотерицин В, амфоглюкамин. Все они относятся к полиеновым антибиотикам. Нистатин и леворин высокоактивны в отношении дрожжеподобных грибов рода Candida. Леворин действует и на трихомонады. Амфотерицин В, амфоглюкамин активны и в отношении возбудителей глубоких системных микозов.
По механизму действия нистатин и амфотерицин В относятся к антибиотикам, нарушаищим молекулярную организацию и функции клеточных мембран грибов. Кроме того, к противогрибовым антибиотикам откосятся гризеофульвин, который обладает фунгистатическим действием в отношении возбудителей парши, трихофитии, микроспории, эпидермофитии и не действует на дрожжеподобные грибы рода Candida
Противоопухолевые антибиотики
К данной группе относятся оливомицин, рибомицин, карминомицин, адриамицин, брунеомицин, дактиномидан, блеомицин. Продуцентами данных антибиотиков являются актиномицеты. Механизм антибластомного действия зависит от нарушения синтеза ДНК или РНК, или той и другой нуклеиновой кислоты.
Для лечения злокачественных новообразований применяют другие химиотерапевтические препараты /сарколизин и др./.
Для того, чтобы антибиотики и другие препараты давали хороший лечебный эффект, необходимо соблюдать следующие требования:
- назначать препарат в соответствии со спектром действия;
- вводить его в дозах, которые подавляют рост и размножение возбудителя данного заболевания;
- создать необходимую концентрацию препарата в организме и поддерживать её в течение всего курса лечения;
- выбрать правильный способ введения препарата;
- учитывать совместимость их при лечении различными препаратами;
- прежде чем лечить, необходимо определить чувствительность возбудителя к антибиотикам, т.е. установить антибиотикограмму.
По степени чувствительности к антибиотикам микробы делят на три группы: чувствительные, умеренно чувствительные и устойчивые. Для определения степени чувствительности исходят из следующих положений:
при введении в организм больного терапевтической дозы антибиотика в сыворотке крови создается определенная концентрация его. Если микробы не растут при этой концентрации препарата, то их считают чувствительными к данному антибиотику.
Умеренно устойчивыми являются микроорганизмы, которые не растут при концентрациях антибиотика, содержащихся в сыворотке крови больных, при использовании максимальных доз препарата.
К устойчивым относятся микроорганизмы, которые растут при концентрациях препарата, находящихся в сыворотке крови больных, при применении максимально допустимых доз антибиотика.
Чувствительность микробов к антибиотикам определяют в основном методом диффузии в агар /дисками/ и иногда методом серийных разведений /табл. 6, 7/.
Для определения чувствительности методом диффузии в агар берут чистую 18-20-часовую культуру бактерий, выросшей на плотной питательной среде /№1, или № 2, или № 3/*.
* Среда № 1 - бульон Хоттингера, агар-агар " Тафуинский", натрий фосфат двузамещенный.
Среда № 2 - мясо-пептонный бульон, агар-агар " Тафуинский", натрий фосфат двузамещенный.
Среда № 3 - сухая питательная среда АГВ /агар Гевенталя и Ведьменой, куда входит сухой питательный рыбный бульон, агар- агар " Тафуинский", крахмал растворимый, натрий фосфат двузамещенный
5-10 изолированных колоний данной культуры суспендируют в физиологическом растворе и титруют по оптическому стандарту на 10 ЕД /при работе со средой № 1 или № 2/, или 5 ЕД /при работе со средой АГВ/, затем взвесь разводят еще 10 раз физиологическим раствором. Далее 1-2 мл взвеси микробов /инокулят/ сразу после изготовления сеют на поверхность агаровой среды, равномерно распределяют путем покачивания чашки, избыток жидкости удаляют пипеткой. Чашки подсушивают приоткрытыми при комнатной температуре в течение 10-15 минут. Затем на поверхность зараженной питательной среды стерильным пинцетом наносят диски, пропитанные антибиотиками на одинаковом расстоянии друг от друга и приблизительно на расстоянии 2 см от края чашки /не более 6 дисков на чашку/. Чашки ставят в термостат при 35-37°С к верху дном, на 18-20 часов.
При определении чувствительности к метициллину и оксациллину чашки ставят в термостат при 35°С.
С помощью линейки, кронциркуля и штангенциркуля измеряют диаметры зон задержки роста микробов вокруг дисков, включая диаметр дисков до 1 мм. Иногда в зоне задержки роста могут быть обнаружены очень мелкие колонии, которые выявляются при определенных условиях освещения. На них не следует обращать внимания. Края зон могут быть не резко очерчены, зоны могут иметь двойные контуры. В этих случаях диаметр зоны измеряют по наиболее четкому контуру. Если по периферии зоны имеются большие колонии, то граница зоны определяется внутренним краем колоний этой группы. Если крупные колонии имеются по всей зоне, то, возможно, культура загрязнена и анализ надо повторить. Если культура чистая, то наличие таких колоний позволяет думать о гетерорезистентной популяции. При определении чувствительности к антибиотикам протеев, обладающих ползучим ростом, зона задержки роста может быть покрыта тонкой пленкой, которая не мешает определению диаметра зоны.
Оценку результатов проводят по таблице 8, в которой приведены пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных микроорганизмов и значений МПК /минимальная подавляющая рост концентрация антибиотика/ для устойчивых и чувствительных штаммов.
Полученные результаты по измерению диаметров зон задержки роста исследуемых культур сопоставляют с пограничными значениями в таблице и относят их к соответствующей категории чувствительности.
Для контроля точности определения чувствительности необходимо наряду с исследуемыми культурами микробов использовать тест-культуры с известной чувствительностью к антибиотикам. По рекомендации ВОЗ для этих целей используются три культуры Американской коллекции типовых культур: E. coli (АТСС 25922), S. aureus (АТСС 25923), P. aureginosa (АТСС 27853). Диаметры зон задержки роста эталонных штаммов должны соответствовать данным, представленным в таблице 9.
Если антибиотики плохо диффундируют в питательную среду /полимиксин, ристомицин/, определение чувствительности микробов к ним нужно проводить методом серийного разведения в жидкой или плотной питательной среде.
Метод двукратных серийных разведений в жидкой питательной среде осуществляется следующим образом: готовят 8-10 двукратных разведений антибиотика. Для этого берут 10 пробирок и в каждую наливают по 2 мл соответствующей жидкой питательной среды. В первую пробирку вносят 2 мл раствора антибиотика определенной концентрации, перемешивают и 2 мл переносят в следующую пробирку, и так последовательно разводят до предпоследней пробирки, из которой 2 мл удаляют. Последняя пробирка является контролем роста культуры. Затем во все 10 пробирок вносят по 0, 2 мл взвеси исследуемой культуры, содержащей 105 -106 микробных клеток в 1 мл в зависимости от вида микроба. Пробирки ставят в термостат при 37 оС на 18-24 час. Результат учитывают по наличию или отсутствию роста микробов в опытных пробирках. МПК антибиотика соответствует концентрации его в последней пробирке, где отмечается задержка роста исследуемой культуры. Затем, по таблице определяют степень чувствительность микроба к антибиотику. Если рост микроба отмечается во всех пробирках, то он устойчив к максимальной взятой в опыт концентрации антибиотика. Если микроб не вырос во всех пробирках, кроме контрольной, то МПК антибиотика в отношении данного микроорганизма меньше используемой концентрации.
Метод серийных разведений в плотной питательной среде в принципе не отличается от вышеизложенного метода. Для его осуществления берут ряд пробирок или флаконов с 1, 5 мл МПА, расплавляют, остужают и добавляют по 1, 5 мл соответствующего разведения антибиотика /в бульоне/, перемешивают и вносят в чашки Петри. Для контроля в пробирку с агаром вместо антибиотика вносят 1, 5 мл стерильной дистиллированной воды. Чашку делят на секторы, на которые сеют исследуемые культуры. Результаты читают через 18-24 час. инкубации в термостате при 37°С. Та наименьшая концентрация антибиотика, которая задерживает рост культуры на поверхности агара и есть МПК антибиотика.
Из изложенных двух методов определения чувствительности микробов к антибиотикам в жидкой и плотной среде более точным является метод серийных разведений в жидкой среде.
При применении антибиотиков и других химиотерапевтических препаратов могут возникнуть осложнения со стороны организма больного и изменения со стороны возбудителя заболевания.
Некоторые антибиотики /пенициллин, стрептомицин/ вызывают аллергические реакции, сопровождающиеся повышением температуры, крапивницей, гиперемией и отеком. От применения пенициллина может быть даже анафилактический шок. Стрептомицин может вызвать контактный дерматит у медицинских работников, которые длительно с ним контактируют, и у больных, которые длительно его применяют.
Исходя из этого, прежде чем вводить антибиотик, необходимо определить, нет ли у больного повышенной чувствительности к нему.
Чувствительность организма человека к антибиотикам проверяется двумя методами:
1) накожной пробой
2) подъязычной пробой
Для постановки накожной пробы на кожу больного в области предплечья скарификатором наносят насечки, в которые наносят капли разведенного антибиотика, растворитель, в котором разведен антибиотик и гистамин (0, 1 % р-р) для определения реактивности кожи. Через 20 - 30 мин в положительном случае отмечается местная реакция на гистамин и антибиотик (покраснение, зуд, иногда папула).
В отрицательном случае местная реакция будет лишь на гисгамин.
Если кожа не реагирует на гистамин, то результат реакции не учитывается.
Подъязычная проба ставится так:
Антибиотик закапывается под язык или им смачивают ватку, которую помещают под язык.
В положительном случае через 20 минут отмечается покраснение, зуд, отечность.
При интенсивной антибиотикотерапии может разрушиться большое количество микроорганизмов с освобождением эндотоксина, который вызывает интоксикацию.
Это явление называется " Реакция обострения" / феномен Герца - Геймера /.
Антибиотики могут нарушать формирование полноценного иммунитета. Так, например, до применения антибиотиков, если больной перенес скарлатину, он приобретал стойкий иммунитет к ней, повторные случаи заболевания встречались редко, а после лечения пенициллином повторные случаи стали встречаться чаще.
Некоторые антибиотики токсичны для определенных органов и тканей. Так, цефалоспорины обладают нефротоксичностью. Тетрациклины - гепатотоксичностью, нефротоксичностью, вызывают раздражение слизистой оболочки желудочно-кишечного тракта, угнетают функцию пищеварительных ферментов.
Аминогликозиды / стрептомицин, мономицин, неомицин/ - ототоксичны и нефротоксичны.
Левомицетин может вызывать тошноту, рвоту, жидкий стул. Большие дозы могут оказывать токсические явления на кроветворную систему.
При длительном применении антибиотиков широкого спектра действия может возникнуть дисбактериоз, так как данные антибиотики оказывают антимикробное действие не только на возбудителей данного заболевания, но и на нормальную микрофлору кишечника.
Дисбактериоз - заболевание, которое возникает в результате нарушения антагонистических отношений между микроорганизмами кишечника. При этом начинают размножаться те микроорганизмы /дрожжеподобные грибы рода Candida, стафилококки, протеи и др./, которые устойчивы к данному антибиотику, ибо микроорганизмы, сдерживающие их размножение, подавлены препаратом. Так возникают кандидомикозы, колиты и др.
Для профилактики кандидомикоза антибактериальные антибиотики назначают совместно с противогрибовыми /нистатином/. Некоторые антибиотики /тетрациклины/ могут обладать тератогенным действием, приводящим к возникновению уродств плода, если женщина принимает их на ранних сроках беременности.
Под влиянием антибиотиков и других химиотерапевтических препаратов возникают атипичные штаммы микроорганизмов, фильтрующиеся и L формы бактерий, которые по целому ряду свойств отличаются от типичных представителей.
Основной причиной недостаточной эффективности химиотерапии является развитие устойчивости возбудителя инфекционного заболевания к применяемому препарату. Существует два экологических источника возникновения и распространения лекарственной резистентности микробов:
1) Стационарные лечебные учреждения
2) Среда обитания основной части людей.
В лечебных учреждениях, где часто применяют химиотерапевтические препараты и где люди находятся в ограниченном пространстве, условия для возникновения и распространения лекарственной устойчивости более благоприятны, чем в других местах.
Однако такие условия могут возникнуть в определенных регионах или в определенных группах людей. Например: при эпидемическом подъеме кишечных инфекций, когда антибиотики назначаются амбулаторно в массовом масштабе, могут формироваться и распространяться штаммы возбудителей этих заболеваний, устойчивые к применяемым препаратам.
Различают две основные разновидности устойчивости:
1) природную или видовую устойчивость, обусловленную свойствами данного вида микроорганизма.
2) приобретенную устойчивость.
Природная или видовая устойчивость определяется отсутствием у микроба " мишени" для действия антибиотика. Например: устойчивость гр - бактерий к бензилпенициллину, или бактерий к противогрибовым препаратам и т.п.
Приобретенная устойчивость возникает в результате мутаций в генах или переноса генов хромосомы, определяющих синтез клеточной стенки, цитоплазматической мембраны, рибасомных и транспортных белков. При этом происходит изменение " мишени" и антибиотик не оказывает антимикробного эффекта.
Наиболее часто приобретанная устойчивость возникает в результате переноса внехромосомных элементов – R-плазмида определяет множественную устойчивость к антибиотикам /к 2-4 и более/ и контролирует синтез ферментов, которые инактивируют или модифицируют антибиотики, нарушающие функции транспортных белков. Так, например, приобретенная устойчивость кβ -лактамным антибиотикам /пенициллинам, цефалоспоринам/ обусловлена наличием у бактерий плазмид, ответственных за образование - лактамазы /пенициллиназы/, которая гидролизирует β -лактамное кольцо пенициллинов и цефалоспоринов с образованием пенициллиновой кислоты и других продуктов, которые не обладают антибактериальной активностью.
R - плазмиды широко распространены среди кокков особенно стафилококков. Перенос этих плазмид осуществляется путем трансдукции.
Устойчивость к левомицетину связана с образованием фермента левомицетин-ацетилтрансферазы, который инактивирует антибиотик. Гр - микроорганизмы образуют ферменты /ацетилтрансферазу, аденил- трансферазу, фосфотрансферазу/, которые вызывают ацетилирование, аденилирование, фосфорилирование аминогликозидных антибиотиков. Устойчивость к тетрациклинам связана с нарушением проницаемости клеточной стенки у устойчивых штаммах. Резистентность к некоторым антибиотикам может быть обусловлена сочетанием нарушения проницаемости клеточной стенки и образованием ферментов.
Устойчивость к антибиотикам у грибов и простейших также обусловлена мутациями в структурных элементах клетки, которые являются мишенью для действия антибиотиков. У вирусов тоже может быть резистентность к химиотерапевтическим препаратам /рифамицину, актиномицину/, которые нарушают синтез вирусных РНК. Это установлено для пикорновирусов, мутанты которых оказались устойчивы к данным антибиотикам.
Устойчивость микроорганизмов специфична, т.е. она отмечается в отношении определенных антибиотиков и родственных к ним групп. Это означает, что у антибиотиков с близкой химической структурой отмечается полная или частичная перекрестная устойчивость. Например, полная перекрестная устойчивость имеется в группе пенициллинорезистентных микроорганизмов между бензилпенициллином и феноксиметилпенициллином, оксациллином и метициллином. Такая же перекрестная устойчивость встречается и среди устойчивых к природным тетрациклиновым антибиотикам, частичная - среди устойчивых к макролидам. Эти явления должны быть учтены при лечении инфекционных заболеваний.
Для предупреждения возникновения и распространения лекарственно-резистентных микроорганизмов необходимо:
1) Изыскивать новые химиотерапевтические вещества с другим механизмом действия.
2) Изменять структуру известных антибиотиков с тем, чтобы бактериальные Ферменты их не инактивировали.
3) Изыскивать вещества, которые разрушали бы бактериальные ферменты, инактивирующие антибиотики, и которые могли бы применяться одновременно с антибиотиками. К таким ингибиторам относится полусинтетическое соединение сульбактам.
В США создан препарат уназин /комбинация ампициллина с сульбактамом/ для внутривенного и внутримышечного применения и сультамициллин - для применения внутрь. Сультамициллин является двойным сложным эфиром, в котором ампициллин и сульбактам соединены метиленовой группой. При всасывании происходит быстрый гидролиз эфирных связей с выходом ампициллина и сульбактама в кровоток.
4) Знать, к каким антибиотикам резистентны микроорганизмы в данном регионе. Это поможет лечащему врачу сделать правильный выбор антибиотика без предварительного определения чувствительности микробов.
Однако и при этих условиях важно, прежде чем лечить больного, определить чувствительность возбудителя данного заболевания к антибиотикам.
5) Не использовать антибиотики для консервирования пищевых продуктов, кормовых добавок и для профилактики заболеваний у животных.
6) Не применять для лечения животных антибиотики, используемые в медицинской практике.
7) Изучать распространенность устойчивых к антибиотикам штаммов в окружающей среде и передачу их с пищевыми продуктами, сточными водами и др. Необходимо также выявлять носительство их среди диких и домашних животных
Таблица 1
| Антибиотики микробного происхождения | ||||||
| АНТИБИОТИКИ, ОБРАЗУЕМЫЕ БАКТЕРИЯМИ | АНТИБИОТИКИ, ОБРАЗУЕМЫЕ ПЛЕСНЕВЫМИ ГРИБАМИ | |||||
| Актиномицетами | Палочковидными | Плесневыми | ||||
| Название АБ | продуцент | Название АБ | Продуцент | Название АБ | Продуцент | |
| 1. Стрептомицин | Streptonyces griseus Str.globispokus Streptonicini | 1. Грамицидин С | B. brevis | 1. Пенициллины | Penicilliurn notatum, Penicilliun chrisogenum | |
| 2. Полимиксин | B. polymyxa | |||||
| 3. Продигиозин | Serratia marcescens | |||||
| 2. Канамицин | Actinomyces Canamyceticus | |||||
| 2. Цефалоспорины | Грибы рода cephalosporiun | |||||
| 3. Гентамицин | Mycromonospora Pulpurea | |||||
| 3. Гризеофульвин | Penicilliun griseofulvium | |||||
| 4. Тетрациклин | Str. Aureofaciens | |||||
| 5. Эритромицин | Str. Erythreus | 4. Микроцид | Грибы рода Penicilliun | |||
| 6. Циклосерин | Str. Lavendulae Str. Orchidaceus | |||||
| 7. Леворин | Str. Levoris |
Таблица 2
| Антибиотики растительного и животного происхождения | ||||
| АНТИБИОТИКИ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ (ФИТОНЦИДЫ) | АНТИБИОТИКИ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | |||
| Название АБ | Продуцент | Название АБ | Продуцент | |
| 1. Новомицин 2. Алилчеп | Трава зверобоя Лук Листья эвкалипта | 1. Лизоцим | Яичный белок | |
| 2. Интерферон | Лейкоциты человека | |||
| 3. Хлорофилипт 4. Гассипол | Семена хлопка или корень хлопчатника |
Таблица 3
| Классификация антибиотиков по химическому составу | |||||
| Азотосодержащие гетероциклические соединения, имеющие β -лактамное кольцо | Ароматические соединения, производные диоксиамино-фенилпропана | Соединения, со- держащие 4 конденсирован-ных шестичленных цикла | Аминогликозиды, в составе которых имеются аминосахара | Макролиды, содержащие макроцикли-ческое лактонное кольцо, связанное с аминосахарами | Полиенобые Соединения - ациклические соединения с несколькими двоичными связями -(СН=СН)- |
| Пенициллины Цефалоспорины | Хлорам/феникол (левомицетин) | Тетрациклин и его производные | Стрептомицин Канамицин Мономицин Неомицин Гентамицин | Эритромицин Олеандомицин Рифамицин | Нистатин Леворин |
Таблица 4
| Классификация антибиотиков по механизму антимикробного действия | ||||
| Ингибиторы синтеза клеточной стенки микроорганизмов | Нарушающие молекулярную организацию и функции клеточных мембран | Подавляющие синтез белка на уровне рибосом | Ингибиторы синтеза РНК | Ингибиторы синтеза ДНК |
| Пенициллины Цефалоспорины Циклосерин | Полимиксины Грамицидин С Нистатин Амфотерицин В | Хлорамфеникол (левомицетин) Эритромицин Линкомицин Фузибин Тетрациклин Стрептомицин Канамицин Гентамицин | Рифампицины Актиномицины | Митомицин С Стрептонигрин Брунеомицин Биомицин |
Таблица 5
| Классификация антибиотиков по спектру действия | |||
| ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ | УЗКОГО СПЕКТРА ДЕЙСТВИЯ | ||
| Антибиотик | Спектр действия | Антибиотик | Спектр действия |
| Аминогликозиды (стрептомицин, канамицин, гентамицин) | Грам (+) и грам (-) кокки, палочки, спирохеты, некоторые действуют на туберкулезные микобактерии и простейшие | Пенициллины | Грам (+) кокки и палочки Грам (-) кокки и спирохеты |
| Тетрациклин | Многие грам (+) и грам (-) кокки и палочки, спирохеты, хламидии, микоплазмы | Макролиды (эритромицин, олеандомицин) | Грам (+) и грам (-) кокки и некоторые другие бактерии, |
| Хлорамфеникол (левомицетин) | Грам (+) кокки и палочки, многие грам (-) палочки, риккетсии, хламидии | Полиены (нистатин) Амфотерицин В | Дрожжеподобные грибы и некоторые простейшие (амебы, лейшмании, трихомонады) |
Таблица 6
| Определение чувствительности микроорганизмов к антибиотикам методом дисков | |||||||||||||||||||||||||||||||||||
1 этап
титрация разведение
1мл
      микробов, выделенная содержащая микробов, выделенная содержащая
средой и нанесение дисков.
Нанесение дисков
3 этап
Измерение диаметра зон задержки роста микробов и определение их степени чувствительности по таблице |
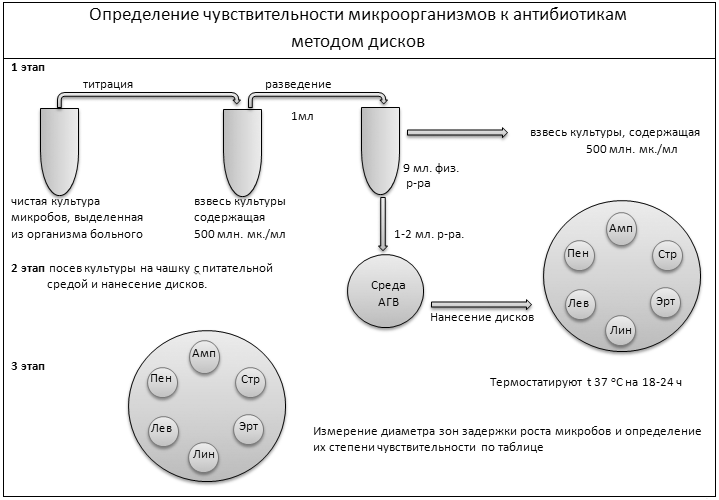
Таблица 7
| Определение чувствительности микроорганизмов к антибиотикам методом серийных разведений в жидкой питательной среде | ||
                                 1 этап. Последовательное двукратное разведение антибиотик500 мкг/л до 1, 95 мкг/л 1 этап. Последовательное двукратное разведение антибиотик500 мкг/л до 1, 95 мкг/л
 антибиотик 2мл. антибиотик 2мл.
       2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл. 2мл.
  2мл 2мл
По 2 мл. пит. ср. 2 этап. Внесение исследуемой культуры. Взвесь культуры, конц 105 мкг/мл
Термостатируют 37 оС 18-24 ч
3 этап. Учет результатов (определение МПК антибиотика и степени чувствительности микроба на таблице).
контроль |

Таблица 8
| Пограничные значения диаметров зон задержки роста и значений МПК антибиотиков для интерпретации результатов | |||||||||||
| Антибиотики | Содержание антибиотика в диске в мкг | Цвет диска | Код диска | Диаметры зон, мм. | МПК, мкг/л | ||||||
| Для сред №1 и №2 | Для среды АГВ | Устойчивый | Чувствительный | ||||||||
| Устойчивый | Умеренно устойчивый | Чувствительный | Устойчивый | Умеренно устойчивый | Чувствительный | ||||||
| Бензилпенициллин: при испытании стафилококков | Бел | ПЕН | ≤ 20 | 21-28 | ≥ 29 | ≤ 20 | 21-28 | ≥ 29 | - | ≤ 0, 1 | |
| при испытании других микроорганизмов | ≤ 11 | 12-21 | ≥ 22 | ≤ 10 | 11-16 | ≥ 17 | - | ≤ 1, 5 | |||
| Ампициллин: при испытании стафилококков | Бел | АМП | ≤ 20 | 21-28 | ≥ 29 | ≤ 20 | 21-28 | ≥ 29 | - | ≤ 0, 2 | |
| при испытании грам (-) бактерий и энтерококков | ≤ 9 | 10-13 | ≥ 14 | ≤ 9 | 10-13 | ≥ 14 | ≥ 30 | ≤ 8 | |||
| Карбенициллин: при испытании культур кишечной палочки и протея | Бел | КАР | ≤ 14 | 15-18 | ≥ 19 | ≤ 14 | 15-18 | ≥ 19 | ≥ 32 | ≤ 16 | |
| при испытании культур | Голуб | ≤ 13 | 14-16 | ≥ 17 | ≤ 11 | 12-14 | ≥ 15 | ≥ 250 | ≤ 125 | ||
| Метициллин | Бел | МЕТ | ≤ 13 | 14-17 | ≥ 18 | ≤ 13 | 14-18 | ≥ 19 | - | ≤ 3 | |
| Оксациллин | - | ОКС | ≤ 19 | 20-23 | ≥ 24 | ≤ 15 | 16-19 | ≥ 20 | - | ≤ 3 | |
| Цефалексин | - | ЦФЛ | ≤ 11 | 12-16 | ≥ 17 | ≥ 32 | ≤ 10 | ||||
| Цефалотин | - | ЦФТ | ≤ 11 | 12-16 | ≥ 17 | ≤ 14 | 15-18 | ≥ 19 | ≥ 32 | ≤ 10 | |
| Стрептомицин | - | СТР | ≤ 13 | 14-16 | ≥ 17 | ≤ 16 | 17-19 | ≥ 20 | ≥ 15 | ≤ 6 | |
| Неомицин | - | НЕО | ≤ 13 | 14-17 | ≥ 18 | ≤ 12 | 13-16 | ≥ 17 | - | ≤ 10 | |
| Канамицин | - | КАН | ≤ 14 | 15-18 | ≥ 19 | ≤ 14 | 15-18 | ≥ 19 | ≥ 25 | ≤ 4 | |
| Мономицин | - | МОН | ≤ 13 | 14-17 | ≥ 18 | ≤ 13 | 14-17 | ≥ 18 | - | ≤ 4 | |
| Гентамицин | - | ГЕН | ≤ 13 | - | ≥ 14 | ≤ 15 | - | ≥ 16 | ≥ 6 | ≤ 2 | |
| Сизомицин | - | СИЗ | ≤ 13 | - | ≥ 14 | ≥ 6 | ≤ 2 | ||||
| Тетрациклин | св. жел | ТЕТ | ≤ 15 | 16-19 | ≥ 20 | ≤ 16 | 17-21 | ≥ 22 | ≥ 12 | ≤ 2 | |
| Доксициклин | Бел | ДОК | ≤ 12 | 13-19 | ≥ 20 | ≥ 12 | ≤ 2 | ||||
| Эритромицин | - | ЭРИ | ≤ 14 | 15-18 | ≥ 19 | ≤ 17 | 18-21 | ≥ 22 | ≥ 8 | ≤ 2 | |
| Олеанцомицин | - | ОЛЕ | ≤ 12 | 13-17 | ≥ 18 | ≤ 16 | 17-20 | ≥ 21 | ≥ 8 | ≤ 2 | |
| Линкомицин | - | ЛИН | ≤ 19 | 20-23 | ≥ 24 | ≤ 19 | 20-23 | ≥ 24 | ≥ 8 | ≤ 2 | |
| Левомицетин | - | ЛЕВ | ≤ 14 | 15-18 | ≥ 19 | ≤ 15 | 16-18 | ≥ 19 | ≥ 16 | ≤ | |
| Рифампицин | св. оран | РИФ | ≤ 9 | 10-12 | ≥ 13 | ≤ 12 | 13-15 | ≥ 16 | ≥ 8 | ≤ 2 | |
| Фузидин | Бел | ФУЗ | ≤ 12 | 13-19 | ≥ 20 | ≥ 16 | ≤ 2 | ||||
| Полимиксин | - | ПОЛ | ≤ 8 | 9-12 | ≥ 13 | ≤ 11 | 12-14 | ≥ 15 | ≥ 50 | - | |
| Ристомицин | - | РИС | ≤ 9 | 10-11 | ≥ 12 | ≤ 9 | 10-11 | ≥ 12 | - | ≤ 5 |
ТАБЛИЦА 9
| Допустимые пределы диаметров зон задержки роста эталонных штаммов при контроле воспроизводимости и точности результатов | ||||||
| Диаметры зон задержки роста на средах №1 и №2, мм. | Диаметры зон задержки роста на среде АГВ, мм. | |||||
| St. Aureus ATCC 25923 | E. coli ATCC 25922 | Ps. aeruginosa ATCC 27853 | St. Aureus ATCC 25923 | E. coli ATCC 25922 | Ps. aeruginosa ATCC 27853 | |
| Бензилпенициллин | - | - | - | 29-38 | - | - |
| Ампициллин | 24-35 | 13-20 | - | 30-36 | 14-20 | - |
| Карбенициллин | - | - | - | 32-38 | 19-25 | - |
| Метициллин | - | 21-26 | 20-24 | 35-42 | 23-29 | 18-24 |
| Оксациллин | - | - | - | 22-30 | - | - |
| Цефалотин | 27-32 | - | - | 24-34 | - | - |
| Стрептомицин | 24-37 | 15-22 | - | 30-40 | 15-20 | - |
| Неомицин | 17-25 | 14-22 | - | 20-25 | 14-19 | - |
| Канамицин | 19-27 | 18-24 | - | 20-27 | 13-17 | - |
| Мономицин | 20-27 | 18-26 | - | 20-27 | 15-19 | - |
| Гентамицин | - | - | - | 22-30 | 14-18 | - |
| Тетрациклин | 20-28 | 20-27 | 16-24 | 22-32 | 21-30 | 16-26 |
| Доксициклин | 20-29 | 19-26 | - | 22-31 | 17-26 | - |
| Эритромицин | 23-31 | - | - | 22-31 | 8-15 | - |
| Олеанцомицин | 20-29 | - | - | 22-29 | - | - |
| Линкомицин | 24-32 | - | - | 24-32 | - | - |
| Левомицетин | 21-27 | 23-28 | 19-25 | 19-27 | - | |
| Рифампицин | - | - | - | 26-34 | 7-11 | - |
| Полимиксин | - | 12-17 | - | - | 16-20 | 15-20 |
| Ристомицин | 14-18 | - | - | 12-16 | - | - |
ЛИТЕРАТУРА
1. Борисов Л.Б., Смирнова А.М.(под редакцией). Медицинская микробиология, вирусология, иммунология. М.: Meдицина, 1994.
2. Бернштейн Е.М.Современные биологические методы оценки активности антибиотиков. Антибиотики и химиотерапия, 1991, № 6.С.50- 52
3. Под редакцией Клюева М.А. Лекарственные средства, применяемые в медицинской практике в СССР.М.: Медицина, 1989.
4. Козырев В.Н. Клинические аспекты фармакокинетики уназина (комбинация ампициллина с сульбактамом). Антибиотики и химиотерапия.1992, № 20, С.46.
5. Машковский М.Д. Лекарственные средства. М.: Медицина, 1993.
6. Навашин С.М., Никитин А.В. Актуальные вопросы создания новых лекарственных препаратов. XIX международный симпозиум по перспестивам развития химиотерапии. Антибиотики и химиотерапия. 1991, №11, С.53.
7. Николаева Н.Б., Альперович Б.Р., Созинов В.Н. и др. Лекарственные препараты зарубежных фирм в России.М.: Астрафармсервис, 1993.
8. Позднякова В.П., Лобусева А.Н., Богомолова Н.С. и др. Лекарственная форма доксициллина гидрохлорида для внутривенного введения при лечении гнойно-септических заболеваний. Антибиотики и химиотерапия. 1992, № 8, С.43.
9. Сидоренко С.В. Цефоперазон и другие цефалоспорины третьего поколения. Антибиотики и химиотерапия, 1992, № 10, С.52
10.Ухтин А.В. Амипицин - основные свойства и особенности применения. Антибиотики и химиотерапия. № 11, 1991, С.47.
11. Яковлев В.П. Симпозиум. Абактал (нефлоксацин) - новые возможности в антибактериальной терапии. Антибиотики и химиотерапия. 1991, № 11, С.52.
|





 взвесь культуры, содержащая
взвесь культуры, содержащая
 чистая культура взвесь культуры
чистая культура взвесь культуры




 Термостатируют t 37 оС на 18-24 ч
Термостатируют t 37 оС на 18-24 ч по 0, 2 мл. в каждую пробирку с соответ. разведением антибиотика
по 0, 2 мл. в каждую пробирку с соответ. разведением антибиотика