
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Потенциометрический метод анализа растворов
|
|
При погружении металлического электрода в раствор на его поверхности возникает потенциал, зависящий от активной концентрации ионов этого металла в растворе. Возникновение потенциала обусловлено переходом ионов металла в раствор. В состоянии равновесия поверхностный потенциал обеспечивает выравнивание скоростей анодного и катодного процессов, связанных с переходом ионов металла в раствор и из раствора в электрод. Измерение поверхностного потенциала электрода позволяет судить о концентрации соответствующих ионов в растворе.
Для равновесного поверхностного потенциала Е необходимо замкнуть электрическую цепь, вводя в раствор второй электрод, называемый вспомогательным или электродом сравнения. Потенциал этого электрода в процессе измерения должен оставаться постоянным.
Если вспомогательный электрод – платиновый водородный, который принят в качестве нормального, то равновесные потенциалы электродов являются измеренными по, так называемой, водородной шкале и считаются нормальными.
Активная концентрация ионов в растворах выражается в единицах десятичного логарифма
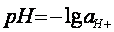 , (7.3)
, (7.3)
где а 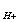 - активная концентрация ионов водорода в растворе.
- активная концентрация ионов водорода в растворе.
Аналогично: pNa = -lg a 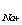

Отсюда, измерительные приборы называются pH-метрами и pNa-метрами.
Чистая вода – нейтральное вещество, слабо диссоциирующее с образованием ионов водорода Н+ и гидроксила ОН.
При t°=22°С константа диссоциации воды
К  = а
= а 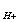
 а
а  =10
=10  ,
,
отсюда
а 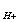 = а
= а  =
=  = 10
= 10 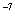 ,
,
значит, pH = 7.
При растворении в воде кислот повышается концентрация ионов водорода Н 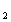 , значит, рН снижается. При растворении в воде щелочей уменьшается а
, значит, рН снижается. При растворении в воде щелочей уменьшается а 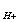 , отсюда, рН возрастает.
, отсюда, рН возрастает.
Таким образом, отклонение рН в водных растворах от 7 в ту или другую сторону характеризует меру их кислотных или щелочных свойств.
Для раствора аммиака: рН = 0¸ 32, 7.
Для муравьиной кислоты: рН = 0¸ 6, 13.