
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Анодный процесс
|
|
При электролитическом рафинировании металлов на аноде происходит полезный процесс – растворение чернового металла. В случае электролиза цинка применять растворимые электроды нельзя, так как при ионизации цинка и примесей многие из них, переходя в раствор, будут соосаждаться с цинком, ухудшая качество катодных осадков. Следовательно, необходимо, чтобы продукты анодного процесса не загрязняли электролит, а сам процесс шел с минимальным расходом электроэнергии. Кроме того, вещества, выделяющиеся на аноде, не должны быть токсичными. В наибольшей степени этим требованиям удовлетворяет процесс анодного разложения воды с образованием кислорода (1.3)
 (1.3)
(1.3)
При этом образуются ионы водорода, которые могут восстанавливаться на катоде вместе с цинком, снижая выход последнего.
В качестве материала анода, обеспечивающего осуществление нужного процесса, который бы при анодном потенциале с учетом перенапряжения кислорода до 2 В не окислялся и не растворялся в электролите используется свинец (чаще Pb +1% Ag). На таком аноде возможно протекание следующих электрохимических реакций:
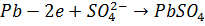 (1.4)
(1.4)
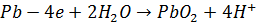 (1.5)
(1.5)
 (1.6)
(1.6)
 (1.7)
(1.7)
Сопоставим равновесные потенциалы этих реакций:
1. 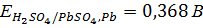
2. 
3. 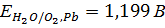
4. 
Таким образом, термодинамически наиболее вероятен процесс ионизации свинца. В реальных условиях электролиза также возможен этот процесс, поскольку он протекает с меньшей поляризацией, чем остальные. Однако эта электрохимическая реакция будет проходить кратковременно, так как в прианодном слое быстро наступает предел растворимости сульфата свинца и электрод покрывается его пленкой. Сульфат свинца обладает низкой электропроводностью и для поддержания заданной скорости электролиза приходится увеличивать анодную поляризацию. В порах пленки сульфата свинца плотность тока возрастает и становится возможным протекание более энергоемкой реакции (1.5). Диоксид свинца, откладываясь в порах рыхлой пленки сульфата, закрывает их, после чего растворение свинцового анода прекращается, так как диоксид свинца обладает электронной проводимостью, то при дальнейшей поляризации анода становится возможным протекание процесса разложения воды с выделением кислорода (1.6). Этот процесс идет на диоксиде свинца с большим перенапряжением и протекает с необходимой скоростью (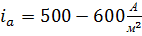 ) при анодном потенциале около 2 В[3].
) при анодном потенциале около 2 В[3].