
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Термодинамика химической коррозии.
|
|
Термодинамику химической коррозии рассмотрим на типичном примере – взаимодействии металлов с кислородом.
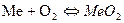 , или в общем случае:
, или в общем случае:
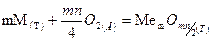 ,
,
где m – число атомов металла в молекуле оксида; n – валентность металла;
Реакция протекает при 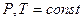 ; уравнение изотермы может быть представлено следующим образом (здесь мы переходим от натурального к десятичному логарифму, вместо активности используем парциальное давление газа):
; уравнение изотермы может быть представлено следующим образом (здесь мы переходим от натурального к десятичному логарифму, вместо активности используем парциальное давление газа):
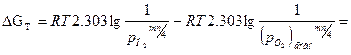
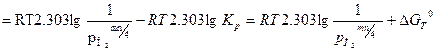 (2)
(2)
где: PO2– парциальное давление кислорода, соответствующее исходному состоянию системы, атм; (PO2)равн. – парциальное давление кислорода соответствующее равновесному состоянию системы (давление диссоциации оксида); Кр– константа химического равновесия;
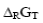 – изменение изобарно – изотермического потенциала;
– изменение изобарно – изотермического потенциала; 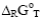 – изменение изобарно – изотермического потенциала при стандартных условиях; R – газовая постоянная; Т – температура;
– изменение изобарно – изотермического потенциала при стандартных условиях; R – газовая постоянная; Т – температура; 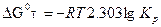 - изменение стандартного изобарно-изотермического потенциала, кал/моль (
- изменение стандартного изобарно-изотермического потенциала, кал/моль (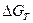 при
при 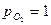 атм).
атм).
Из уравнения (2) следует, что самопроизвольное протекание реакции окисления металла кислородом возможно (∆ GТ< 0), если при данных условиях рO2> (рO2)равн,
и невозможно (∆ GТ > 0), если рO2< (рO2)равн.